腎機能障害
患者に腎機能障害がある場合,薬物療法を慎重に検討する必要がある。その理由の一部は,腎毒性がある薬剤が存在することであるが,主な理由は腎機能障害があると薬物動態(吸収,分布,代謝,排泄)に影響が生じるためである。特に,腎機能障害を有する患者は薬物やその代謝産物を排泄する能力が低下している。
腎機能障害がある場合の処方─一般原則
-
糸球体濾過量(GFR)を算出し, 腎臓の排泄能力を推定する。GFRは以下の測定値により評価する。
- 理想的な濾過マーカーには,例えばイヌリンまたはエチレンジアミン四酢酸(EDTA)がある(これらは正確な推定値が得られるが高価で侵襲的)。
- 血清クレアチニン:簡単で安価な方法であるが,必要な調整を行った後でさえ腎機能の概算しか得られない。
- シスタチンC蛋白:クレアチニンよりも高価な検査であるが精度は高い
- 尿中アルブミン量を測定することによって蛋白尿を確認し,アルブミン/クレアチニン比を算出する。これを行うのは,蛋白尿が末期腎疾患への進行の重大な危険因子であるからである1 。
- 血清クレアチニンおよびシスタチンCを用いたGFR値の精度を向上させるために,その他の因子を組み込んだ式を使用する(以降の式を参照のこと)。これらの推定値はGFRの直接的な測定値と比較すると,依然として完璧ではないことに注意すること2,3。CKD-EPIはMDRDよりも精度が高く,現在ではこちらが好まれている。
|
a)Cockcroft-Gault 式*
F=1.23(男性)および1.04(女性) 患者の体重が極端に重い場合や軽い場合は正確に計算できないので,理想体重を用いる。 男性の理想体重(kg)=50 kg+2.3 kg(5フィート超の場合1インチ毎に加算していく) 女性の理想体重(kg)=45.5 kg+2.3 kg(5フィート超の場合1インチ毎に加算していく)
*この計算式は血漿中クレアチニンが不安定(例:急性腎不全)である場合,肥満,妊婦,小児である場合,異常な量のクレアチニンを産生する疾患の場合は正確ではない。白人患者でのみ妥当性が確認されている。また重度の腎不全の患者では,クレアチニンクリアランスはGFRと同等ではなく,GFRの指標として正確性に欠ける。 |
|
b)Chronic Kidney Disease Epidemiology Collaboration(CKD-EPI)式[この式がこれまで用いられていたModification of Diet in Renal Disease(MDRD)式に置き換わっている2が,一部の病理検査部門ではまだMDRDを用いている]。 GFR = 141 × min(Scr/κ, 1)α ×max(Scr/κ, 1)-1.209×0.993Age×1.018[女性の場合]× 1.159[黒人の場合] Scr は血清クレアチニン(mg/dL)κは女性の場合 0.7,男性の場合 0.9 αは女性の場合-0.329,男性の場合-0.411 min は Scr/κの最小値または 1 を示す max は Scr/κの最大値または 1 を示す
|
腎機能障害の病期を分類する3
図8.1 腎機能障害の分類
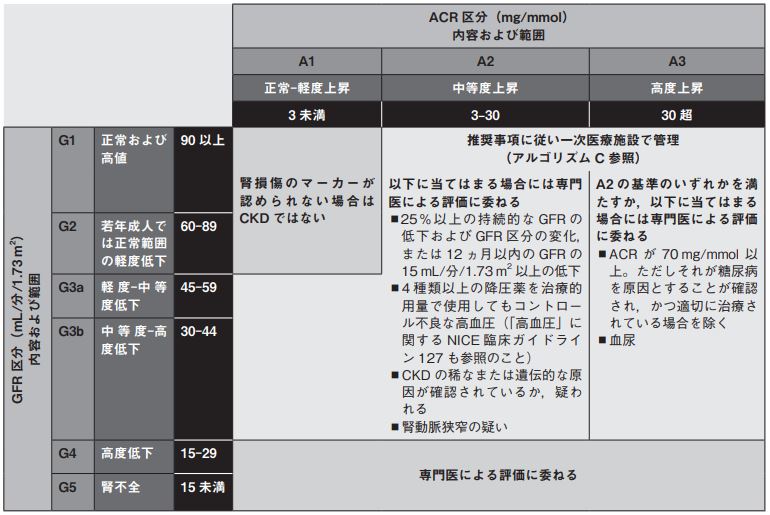
ACR:アルブミン/クレアチニン比,CKD:慢性腎臓病,GFR:糸球体濾過量
注意事項
- 2年間で30%の変化が末期腎不全リスクの5倍上昇と関連していることから,相当長い期間にわたって腎機能の低下をモニタリングする。慢性腎臓病の進行は直線的でないことが多い4。
- 慢性腎臓病の病期3-5(eGFR 10-59)から透析/移植へと移行するリスクをモニタリングする。その際,次のTangriスコアを用いる。https://qxmd.com/calculate/calculator_125/kidney-failure-risk-equation8-variable。これは,4変数(年齢,性,eGFR,尿アルブミン/クレアチニン比)と8変数(4項目に血清カルシウム,血清リン,血清重炭酸,血清アルブミンの値を加えたもの)による式で,これによって,慢性腎臓病の病期3-5の患者が,2年および5年のうちに腎不全の治療(透析または移植)を受ける確率が正確に予測できる5。
- 一般的に腎機能は全体的な薬剤の排泄に重大な影響を及ぼす。それゆえ,未変化体として尿中に排泄される薬剤の量は,用量の30%以上であるべきである6。
- 高齢者(65歳超)は少なくとも軽度腎機能障害を有すると想定すべきである。高齢者は筋量が少ないため,血清クレアチニン値が上昇しないことがある。
- 腎予備能が限られている場合は腎毒性のある薬剤(例:リチウム,NSAIDs)を使用しない。
- 腎排泄量に強く依存する薬剤を使用する場合は注意する(例:スルピリド,amisulpride,リチウム)。
- 腎疾患があると,尿毒症に起因する酵素活性阻害が起こるおそれがあり,それによって肝で代謝された薬剤の排泄量が低下する可能性がある7。
- 腎機能障害があると,薬剤の半減期や定常状態(薬剤が連続的に投与されるときに,吸収量が消失量と同じになった状態)に達するまでの時間が長くなることが多いため,投与は低用量から開始し,徐々に増量する。一部の薬剤については,血漿中濃度モニタリングが有用であると思われる。
- 長時間作用型の薬剤は避けるよう努める(例:デポ剤)。そうした剤形では仮に腎機能が変化しても,用量や投与頻度を容易に調節できない。
- 処方する薬剤の数はなるべく少なくする。腎不全患者では多くの薬剤が処方されており,定期的に見直す必要がある。薬剤の数が少なければ,相互作用や副作用を避けることができる。
- 副作用がないかどうか継続的なモニタリングを行う。腎機能障害のある患者では,健常者に比べて副作用が発現しやすく,また副作用発現までに時間がかかることがある。鎮静,錯乱,起立性低血圧等の副作用が多くみられることがある。
- 尿閉が起こるおそれがあるため,抗コリン作用のある薬剤は慎重に使用する。
- 腎機能障害のある患者での向精神薬の使用を評価した臨床研究はほとんどない。腎機能障害での薬物療法に関する推奨は,健常者の薬物動態の知見に基づいていることが多い。
- 腎代替治療(透析等)が薬剤に及ぼす影響は予測困難である。表 8.8-8.13 を参照のこと。専門家の助言を仰ぐこと。
- QTc 間隔延長作用が知られている薬剤は避けるよう努める。腎不全が確立している場合,電解質が変化していることが多いため,QTc 延長リスクが特に高い抗精神病薬はできる限り使用しない(QTc 延長についての項を参照のこと)。
- 体重を綿密にモニタリングする。体重増加は糖尿病の引き金となり,糖尿病は横紋筋融解症 8や腎不全を起こすおそれがある。向精神薬は,体重を増加させることが多い。
- 抗うつ薬によるセロトニン症候群,抗精神病薬によるジストニアおよび神経遮断薬悪性症候群(NMS)に十分注意する。これらが原因で横紋筋融解症が生じると,腎不全が起こるおそれがある。抗精神病薬投与により,NMS の他の症状のない横紋筋融解症が生じたという症例報告がある9-11。
- 慢性腎臓病ではうつ病が合併することが多いが,この状態に対する抗うつ薬の有効性については,エビデンスは得られていない12,13。慢性腎臓病では,一部の抗うつ薬を高用量で開始すると,低用量で開始した場合と比べて死亡リスクが低下する14。血液透析患者のうつ病治療は十分には行われていない15。認知行動療法,運動,リラクセーション法などの薬物療法以外の治療法は,おそらく成人透析患者のうつ病の症状を緩和する16。SSRIは血液透析患者の股関節骨折と関係している(AOR 1.25,95%CI=1.17-1.35)17。
- 統合失調症および双極性障害ではいずれも慢性腎臓病のリスクが高くなる18, 19。
- 抗精神病薬(例:オランザピン,クエチアピン)は急性腎障害に関連することがあり20,これはおそらく,血圧および尿閉に及ぼす作用が原因と想定されるが,研究結果は相反している21。
- 双極性障害で用いられる気分安定性抗けいれん薬は,慢性腎臓病発現率の上昇と関連している19。
表8.8 腎機能障害がある場合の抗精神病薬
| 薬剤 | コメント |
| amisulpride22-25 | 主に腎から排泄される。50%が未変化体として尿中に排泄される。腎疾患に対する投与の経験は少ない。製薬会社からは50mgを超える用量を投与した場合のデータは示されていないが,以下の用量に従って投与することが推奨されている。GFRが30-60mL/分の場合は通常量の50%,GFRが10-30mL/分の場合は通常量の33%を投与し,GFRが10mL/分未満の場合は推奨がない。したがって,明らかな腎不全の場合は投与を避けることが望ましい |
| アリピプラゾール22,23,25-29 | 未変化体として腎から排泄されるのは1%未満である。薬物動態が健常者と重度腎疾患患者で同様なため,製薬会社は腎不全であっても用量調節の必要はないとしている。83歳の男性血液透析患者1例で,経口アリピプラゾール5mgを使用しても安全であったとの症例報告がある。現在のところ,64歳の男性血液透析1例で,アリピプラゾール400mgデポ剤使用の症例報告があるものの,可能ならデポ剤は避けること |
| アセナピン23, 25, 30 | 製薬会社は,腎機能障害例であっても用量の調節は必要がないとしているが,GFRが15mL/分未満の症例に対する使用経験はない。腎機能障害例を対象とした5mgの単回投与試験では,用量の調節は必要がないと示唆されている。軽度(eGFR 60-89mL/分/1.73m2),中等度(eGFR 30-59mL/分/1.73m2),重度(eGFR 15-29mL/分/1.73m2)の腎機能障害例のいずれでも用量の調節は推奨されていない |
| クロルプロマジン22, 23, 25, 31, 32 | 未変化体として尿中に排泄されるのは1%未満である。製薬会社は腎機能不全の場合は使用を避けるように推奨している。用量:GFRが10-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが10mL/分未満の場合は抗コリン作用,鎮静作用,低血圧作用の副作用リスクが増大するため,少量から開始する。綿密なモニタリングを行うこと |
| クロザピン23, 25, 33-37 | 未変化体として尿中に排泄される量は微量であるが,稀に間質性腎炎および急性腎不全の症例報告がある。よくみられる副作用は夜尿症や尿閉である。製薬会社は,重度腎疾患がある場合の投与は禁忌としている。腎疾患患者では,抗コリン作用,鎮静,低血圧の副作用の発生頻度が高まる。用量:GFRが10-50mL/分の場合は腎機能が正常な場合と同様であるが,慎重に投与する。GFRが10mL/分未満の場合は(腎臓専門医の意見に基づき)低用量から始めて,徐々に増量する。投与量の指針として薬物濃度が有用である。腎疾患の一般的な原因の1つである,糖尿病の発症や悪化をもたらすことがある。腎移植後に継続投与が成功した症例報告がある38 |
| flupentixol 22, 23, 25 | 未変化体として腎から排泄される量はごくわずかである。用量:GFRが10-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが10mL/分未満の場合は,通常の用量の1/4-1/2から開始し,徐々に増量する。腎機能障害があると低血圧や鎮静が生じることがあり,蓄積の可能性もある。製薬会社は,腎不全がある場合は慎重に投与するよう推奨している。腎機能障害がある場合には,持効性製剤は避けること |
| ハロペリドール10, 22, 23, 25, 39, 40 | 未変化体として尿中に排泄されるのは1%未満である。製薬会社は,腎不全がある場合は慎重に投与するよう推奨している。用量:GFRが10-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが10mL/分未満の場合は,反復投与により蓄積する可能性があるため,低用量から開始する。腎不全でハロペリドールを使用した症例報告では,低用量から開始し,徐々に増量することが提案されている。腎不全で悪心を伴う尿毒症を治療するために使用されている。腎機能障害がある場合には,持効性製剤は避けること |
| lumateperone41, 42 | 未変化体として尿中に排泄されるのは1%未満である。製薬会社は,腎機能障害例であっても用量の調節は必要がないとしている |
| ルラシドン43 | 9%が未変化体として尿中に排泄される。製薬会社は,GFRが50mL/分未満の症例では用量を調節し[開始用量は18.75(20)mg/日,最大用量は74(80)mg/日である],GFRが15mL/分未満の症例では投与を控えるように推奨している。腎不全の報告が稀にある |
| オランザピン9, 22, 23, 25, 40, 44 | 57%が主に代謝産物として(7%は未変化体として)尿中に排泄される。用量:GFRが50mL/分未満の場合は,初期量として5mg/日を投与し,必要であれば増量する。経口薬での十分な忍容性と有効性がない限り,腎機能障害時には持効性製剤を避けること。製薬会社の推奨では,腎機能障害例に持効性注射剤を使用する場合は,開始量を150mgとして4週毎に投与することとされている。腎疾患の一般的な原因の1つである,糖尿病の発症や悪化をもたらすことがある。腎不全での使用で低体温が報告されている |
| パリペリドン22, 23, 25 | パリペリドンはリスペリドンの代謝産物でもある。59%が未変化体として尿中に排泄される。用量:GFRが50-80mL/分の場合は3mg/日から始めて,反応に応じて最大6mg/日まで増量する。GFRが10-50mL/分の場合は3mg隔日投与から,反応に応じて3mg/日に増量する。重度の腎疾患ではクリアランスが71%低下するため,慎重に投与すること。製薬会社は,GFRが10mL/分未満の場合の経口投与および,GFRが50mL/分未満の場合1ヵ月毎および3ヵ月毎いずれの持効性製剤投与も,経験がないため禁忌としている(GFRが50mL/分以上80mL/分未満の場合には開始および維持用量を減量)。血液透析を受けている腎不全患者においてパリペリドンの毎月投与が成功した症例報告が1例ある45 |
| pimavanserin 41, 46 | 未変化体として尿中に排泄されるのは1%未満である。製薬会社は,GFRが30mL/分以上の場合は用量の調節は必要がないとしているが,GFRが30mL/分未満の場合はデータが不足しているため,投与は避けるよう推奨している |
| ピモジド22, 23, 25 | 未変化体として尿中に排泄されるのは1%未満である。腎機能障害があっても通常は減量の必要はない。用量:GFRが10-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが10mL/分未満の場合は低用量から開始し,反応に応じて増量する。製薬会社は,腎不全がある場合は慎重に投与するよう推奨している |
| クエチアピン22, 23, 25, 47-49 | 未変化体として尿中に排泄されるのは5%未満である。GFRが30mL/分未満の患者では,血漿クリアランスが平均25%低下する。GFRが10-50mL/分未満の患者では25mg/日から開始し,1日25-50mgの割合で有効量まで増量する。本剤により結果的に急性腎不全をきたしたという症例報告[血栓性血小板減少性紫斑病,薬剤性過敏症症候群(DRESS)および非NMS性の横紋筋融解症]が報告されている |
| リスペリドン22, 23, 25, 40, 50-53 | 中等度から重度の腎疾患症例では,リスペリドンとその活性代謝産物(9-OHリスペリドン)のクリアランスが60%低下する。用量:GFRが50mL/分未満の場合は,0.5mgを1日2回で1週間以上投与した後,0.5mg(1日2回)ずつ増量し,1-2mgを1日2回まで漸増する。製薬会社は,腎機能障害がある場合は慎重投与を推奨している。持効性注射剤は,上述の方法に従って経口薬を増量した後でのみ使用すること。2mg経口投与に忍容性がある場合は,2週間毎に25mgを筋肉内投与してもよい。血液透析患者で,持効性注射剤を投与して問題がなかったとする症例報告が2件ある。1例は2週間毎に50mg,もう1例はその例より年齢が高い成人で37.5mgから25mgへ減量した患者であった。他の報告では,ステロイド誘発性精神病とネフローゼ症候群の小児にリスペリドンを投与して問題がなかったとされている |
| スルピリド8, 22, 23, 25, 54 | ほぼすべてが腎から排泄され,95%が未変化体として尿中および糞便中に排泄される。用量:GFRが30-60mL/分の場合は通常量の70%を投与する。GFRが10-30mL/分の場合は通常量の50%,GFRが10mL/分未満の場合は通常量の34%を投与する。スルピリドを投与した患者に糖尿病性昏睡と横紋筋融解症が生じ,腎不全をきたした症例報告がある。腎機能障害がある場合は使用しないことが望ましいであろう |
| trifluoperazine 25 | 未変化体として尿中に排泄されるのは1%未満である。用量:GFRが10-50mL/分未満の場合は,腎機能が正常な場合と同様に投与するが,低用量から開始する。データは非常に限られている |
| ziprasidone 22, 40, 55, 56 | 未変化体として排泄されるのは1%未満である。GFRが10mL/分を超えていれば用量調節は不要であるが,注射剤には腎で除去される添加物(シクロデキストリンナトリウム)が含まれているため,注射剤を使用する場合は注意が必要である。血液透析を受けていた患者に80mgを1日2回投与したところ,顆粒球減少症を発現したという症例報告がある57 |
| zuclopenthixol 22, 23, 25 | 10-20%の未変化薬物および代謝産物が未変化体として尿中に排泄される。蓄積の可能性があるため,腎疾患がある場合は慎重に投与するよう製薬会社は推奨している。用量:GFRが10-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが10mL/分未満の場合は用量の50%から開始し,徐々に増量する。腎機能障害がある場合,(zuclopentixol acetateとzuclopentixol decanoateの)持効性製剤はいずれも避けること |
GFR:糸球体濾過量,NMS:神経遮断薬悪性症候群
表8.9 腎機能障害がある場合の抗うつ薬12
| 薬剤 | コメント |
| agomelatine23 | 未変化体としてはほとんど腎排泄されない。腎疾患の患者での使用データはない。製薬会社によると,重度の腎機能障害患者に25mgを投与した小規模試験で薬物動態の変化は認められなかったが,中等度または重度の腎疾患の場合は慎重に投与するよう推奨している。ラットにおいて腎保護作用が認められている58,59 |
| アミトリプチリン22, 23, 25, 32, 40, 60-64 | 未変化体として尿中に排泄されるのは2%未満である。腎不全でも用量調節は不要である。腎機能が正常な場合と同様に投与するが,低用量から開始して徐々に増量する。尿閉,錯乱,鎮静,起立性低血圧が起きていないかモニタリングすること。本剤は腎疾患患者の疼痛治療に用いられている。血漿中濃度とECGによるモニタリングが有用と考えられる。急性腎障害と関連している |
| brexanolone 41, 65 | 未変化体として排泄されるのは1%未満である。製薬会社はGFRが15-60mL/分の場合,用量調節は不要としている。GFRが15mL/分未満の患者に対しては,注射可溶化剤(スルホブチルエーテルβ-シクロデキストリンナトリウム)の蓄積の可能性があるため,使用を避けるように推奨している |
| bupropion 22, 23, 25, 32, 40, 66-68 (amfebutamone) |
未変化体として尿中に排泄されるのは0.5%である。用量:GFRが50mL/分未満の場合は,150mgを1日1回投与する。血液透析患者(慢性腎臓病ステージ5)を対象とした単回投与試験では,150mgを3日毎に投与することを推奨している。腎機能障害があると代謝産物が蓄積する可能性があり,クリアランスは低下する。濃度が上がると,けいれん発作のリスクが上昇する。慢性腎臓病で軽度から中等度のうつ病を有する患者の性機能障害の治療に使用されている |
| citalopram22, 23, 25, 40, 69-75 | 未変化体として尿中に排泄されるのは13%未満である。軽度および中等度の腎機能障害患者を対象とした単回投与試験では,薬物動態の変化は認められていない。腎機能が正常な場合と同様に投与を行うが,GFRが10mL/分未満の場合はクリアランスが低下するため,注意が必要である。製薬会社は,GFRが20mL/分未満の場合は使用しないよう推奨している。本剤の過量投与による腎不全が報告されている。本剤は慢性腎不全のうつ病を治療するために使用でき,QOLを改善させるが,本剤(またはエスシタロプラム)の使用は,血液透析を受けている症例に使用した場合,他のSSRI(fluoxetine,フルボキサミン,パロキセチン,セルトラリン)に比べて心臓突然死のリスクが高い(補正後ハザード比1.18,95%CI=1.05-1.31)。腎移植例にcitalopramを投与したところ,低ナトリウム血症が生じたという症例報告が1件ある |
| クロミプラミン22, 23, 25, 32, 76 | 未変化体として尿中に排泄されるのは2%である。用量:GFRが20-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが20mL/分未満の場合の影響は不明であるが,蓄積する可能性があるため,低用量から開始し,尿閉,錯乱,鎮静,起立性低血圧のモニタリングを行う。クロミプラミン誘発性の間質性腎炎と可逆的な急性腎不全の症例報告がある |
| desvenlafaxine 12, 22, 77, 78 | 45%が未変化体として尿中に排泄される。製薬会社は以下のように推奨している。GFRが30-50mL/分の場合は50mg/日,GFRが30mL/分未満の場合は25mg/日。GFRが低下すると半減期が長くなり,蓄積する。副作用としては尿閉,排尿の遅れ,蛋白尿が報告されている |
| ドスレピン22, 25, 79 (dothiepin) |
56%が主に活性代謝産物として腎から排泄される。半減期が長く,蓄積して,過度の鎮静を生じる可能性がある。用量:GFRが20-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが20mL/分未満の場合は低用量から開始し,反応に応じて増量する。尿閉,錯乱,鎮静,起立性低血圧のモニタリングを行うこと |
| doxepin22, 23, 25, 32, 80 | 未変化体として尿中に排泄されるのは1%未満である。用量:GFRが10-50mL/分の場合は腎機能が正常な場合と同様に投与するが,尿閉,錯乱,鎮静,起立性低血圧が起きていないかモニタリングすること。GFRが10mL/分未満の場合は低用量から開始し,徐々に増量する。製薬会社は慎重な投与を推奨している。本剤を投与した患者で腎不全を伴う溶血性貧血が報告されている。慢性腎不全の掻痒症治療に局所的に用いられている |
| デュロキセチン22, 25, 81-83 | 未変化体として尿中に排泄されるのは1%未満である。GFRが30mL/分を超えていれば用量調節は不要だが,低用量から開始して徐々に増量するよう製薬会社は推奨している。慢性腎臓病では蓄積する可能性があるため,GFRが30mL/分未満の症例では,禁忌である。本剤は,糖尿病性神経障害性疼痛と女性の腹圧性失禁の治療薬として承認されている。糖尿病は腎機能障害の一般的な原因の1つである。デュロキセチンによる急性腎不全の症例報告が2件ある。トラゾドンおよびデュロキセチンを投与中の慢性腎臓病例においてセロトニン症候群が報告されている84 |
| エスシタロプラム22, 25, 75, 85-87 | 8%が未変化体として尿中に排泄される。製薬会社は,軽度または中等度の腎機能障害患者では用量調節は不要だが,GFRが30mL/分未満の場合は注意が必要であり,低用量から開始して徐々に増量するよう推奨している。本剤に関しては可逆性の腎尿細管障害の症例研究と腎不全の症例研究がある。うち1つの研究によると,末期腎疾患ではプラセボとの比較で有効であった。本剤(またはcitalopram)の使用は,血液透析を受けている患者に使用した場合,他のSSRI(fluoxetine,フルボキサミン,パロキセチン,セルトラリン)に比べて心臓突然死のリスクが高い(補正後ハザード比1.18,95%CI=1.05-1.31) |
| fluoxetine 13, 22, 23, 25, 32, 40, 88-91 | 2.5-5%の未変化体と10%の活性代謝産物norfluoxetineが未変化体として尿中に排泄される。用量:GFRが20-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが20mL/分未満の場合は低用量を投与するかまたは隔日で投与し,反応に応じて増量する。(GFRが10mL/分未満の透析症例で)20mg投与開始から2ヵ月後の血漿中濃度は,腎機能が正常な患者と同様の値である。うつ病と腎疾患を対象とした有効性試験では,相反する結果が得られている。長期透析患者を対象とした1件の小規模プラセボ対照試験では,投与8週後に両患者群のうつ病スコアに有意差はみられなかった。別の試験では有効性が認められた。症例集積研究(n=4)では,血液透析を受けているうつ病症例にfluoxetineを週1回90mgまたは180mgを投与したところ,用量90mgが忍容性良好で有効であることが示された |
| フルボキサミン22, 25, 32, 40, 63 | 未変化体として尿中に排泄されるのは2%である。腎機能障害例における使用についてはほとんど情報がない。製薬会社は,腎機能障害では慎重に投与するよう推奨している。用量:GFRが10-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが10mL/分未満の場合も腎機能が正常な場合と同様に投与するが,低用量から開始し,徐々に増量する。急性腎不全の報告がある。血液透析例では,アルブミン値の違いが,フルボキサミン血清中濃度に影響を及ぼす可能性がある |
| イミプラミン22, 23, 25, 32, 60 | 未変化体として尿中に排泄されるのは5%未満である。腎機能障害(GFRが10mL-50mL/分未満)でも特に用量調節は必要ではない。尿閉,錯乱,鎮静,起立性低血圧が起きていないかモニタリングすること。本剤の投与を受けた症例で腎機能障害が報告されており,製薬会社は,重度の腎機能障害がある場合は注意するよう推奨している。腎機能障害の報告は稀である |
| ロフェプラミン22, 23, 25, 92 | 腎機能障害での使用についてはほとんど情報がない。未変化体として尿中に排泄されるのは5%未満である。用量:GFRが10-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが10mL/分未満の場合は低用量から開始し,徐々に増量する。製薬会社は,重度腎機能障害での投与は禁忌としている。イミプラミンと同様に,デシプラミンが主要な代謝産物である |
| ミルタザピン22, 23, 25, 93 | 75%が未変化体として尿中に排泄される。GFRが11-39mL/分の患者ではクリアランスが30%低下し,GFRが10mL/分未満の患者では50%低下する。用量:GFRが10-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが10mL/分未満の場合は低用量から開始し,綿密なモニタリングを行う。本剤は腎不全による掻痒症および透析例の食欲不振の治療に用いられている94。稀に腎結石形成を伴う |
| moclobemide22, 23, 25, 95, 96 | 未変化体として尿中に排泄されるのは1%未満である。腎機能障害患者で活性代謝産物の増加が認められたが,投与量に影響を及ぼすほどではないとみなされた。製薬会社は,腎機能障害があっても用量を調節する必要はないとしている。用量:GFRが10-50mL/分未満の場合は腎機能が正常な場合と同様に投与する |
| ノルトリプチリン22, 25, 32, 40, 60, 97 | 未変化体として尿中に排泄されるのは5%未満である。GFRが10-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが10mL/分未満の場合は低用量から開始する。腎機能障害があると血漿中の活性代謝産物の濃度が上昇するため,投与量が100mg/日を超える場合は血漿中濃度モニタリングが推奨される。高齢のケースではGFR低下も報告されている。血漿中濃度モニタリングが有用である可能性がある |
| パロキセチン22, 23, 25, 32, 98-101 | 未変化体として尿中に排泄されるのは2%未満である。単回投与試験では,GFRが30mL/分未満の場合に血漿中パロキセチンの濃度が上昇している。用量に関して一致した見解は得られていないが,GFRが30-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが10-30mL/分未満の場合は10mg/日から開始し(20mgから開始するという意見もある),反応に応じて増量する。パロキセチン10mg/日と心理療法の併用は,慢性血液透析患者のうつ病に有効であった。稀にファンコニー症候群および急性腎不全を伴うことがある |
| phenelzine 22, 25 | 未変化体として尿中に排泄されるのは約1%である。腎不全でも用量を調節する必要はない |
| reboxetine22, 23, 25, 102, 103 | 約10%の未変化薬剤が未変化体として尿中に排泄される。用量:GFRが20mL/分未満の場合は,2mgを1日2回投与し,反応に応じて用量を調節する。腎機能が低下すると,半減期が長くなる |
| セルトラリン22, 23, 25, 32, 104-108 | 0.2%未満の未変化セルトラリンが未変化体として尿中に排泄される。単回投与試験では,腎機能障害があっても薬物動態の変化は認められていないが,反復投与について発表されたデータはない。投与は腎機能が正常な場合と同様に行う。セルトラリンは透析に伴う低血圧109や尿毒症性掻痒症の治療に用いられているが,急性腎不全の報告があるため,慎重に用いるべきである。全体として,うつ病と慢性腎臓病を有する症例への本剤使用に関する複数の研究で,有効性がないことが示されている。透析を受けていない慢性腎臓病を対象とした本剤(用量中央値150mg)対プラセボ対照RCTであるCAST試験では,抑うつ症状に対して有意差はないことが明らかになった108。血液透析中のうつ病例におけるセルトラリン(最大200mg)とCBTを比較するASCEND試験では,反応率と寛解率に有意差はないことが示されたが,12週時点のQIDS-Cうつ病スコアはセルトラリンの方がCBTより低かった110。血液透析中のうつ病症例における別の小規模RCT(ASSertID試験)では,セルトラリンとプラセボに差がないことが報告された111。血液透析中の症例へのセルトラリンの使用は,セロトニン症候群に関連した。末期腎不全例に使用した場合に好中球減少症が生じた症例報告がある112。血液透析を受けているうつ病症例においてCRPを低下させる可能性があり113,慢性腎臓病のうつ病症例においてCRP高値がセルトラリンへの反応として予想されることがある(プラセボでは予想されなかった)114 |
| トラゾドン22, 23, 25, 115 | 未変化体として尿中に排泄されるのは5%未満であるが,活性代謝産物も約70%排泄されるため,注意が必要である。用量:GFRが20-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが10-20mL/分の場合も腎機能が正常な場合と同様に投与するが,少量から開始し,徐々に増量する。GFRが10mL/分未満の場合は少量から開始し,徐々に増量する。トラゾドンおよびデュロキセチン投与中の慢性腎臓病患者でセロトニン症候群が報告されている84 |
| トリミプラミン22, 25, 32, 60, 116, 117 | 腎機能障害がある場合でも投与量の減量は不要であるが,尿素増加,急性腎不全,間質性腎炎が報告されている。腎機能障害の症例では尿閉,錯乱,鎮静,起立性低血圧の副作用のリスクが高いため,他のあらゆる三環系抗うつ薬と同じく,それらの副作用のモニタリングを行うこと |
| ベンラファキシン22, 23, 32, 118-120 | 1-10%が未変化体として尿中に排泄される(30%は活性代謝産物として排泄)。腎機能障害があるとクリアランスが低下し,半減期が長くなる。用量に関して一致した見解は得られていないが,GFRが30-50mL/分の場合は腎機能が正常な場合と同様に投与するか,投与量を50%減量する。GFRが10-30mL/分の場合は投与量を50%減量し,1日1回錠剤を投与する。GFRが10mL/分未満の場合も投与量を50%減量し,1日1回投与する。本剤の投与を受けた患者で横紋筋融解症および腎不全が稀に報告されている。本剤は血液透析患者の糖尿病性末梢神経障害の治療に用いられている。高用量では高血圧が生じるおそれがある |
| ボルチオキセチン23, 121 | 未変化体として尿中に排泄される量はわずかである。製薬会社は,腎機能障害や末期腎疾患でも用量を調節する必要はないとしているが,注意して投与するよう推奨している |
CBT:認知行動療法,CRP:C 反応性蛋白,ECG:心電図,GFR:糸球体濾過量,RCT:無作為化比較試験
表8.10 腎機能障害がある場合の気分安定薬
| 薬剤 | コメント |
| カルバマゼピン22, 23, 25, 122-129 | 未変化体として尿中に排泄されるのは2-3%である。腎疾患があっても投与量を減らす必要はないが,稀に腎不全,腎尿細管壊死,尿細管間質性腎炎の症例が報告されており,代謝産物が蓄積する可能性がある。スティーブンス・ジョンソン症候群や中毒性表皮壊死症の原因となり,急性腎不全をきたすおそれがある。双極性障害における維持療法は慢性腎臓病の発生率の増加に関連する19 |
| ラモトリギン22, 23, 25, 130-134 | 未変化体として尿中に排泄されるのは10%未満である。腎不全を対象とした単回投与試験では,薬物動態への影響はほとんどなかったが,不活性代謝産物が蓄積し(影響は不明),半減期が長くなる可能性がある。腎不全や間質性腎炎も報告されている。用量:GFRが10-50mL/分未満の場合は慎重に使用し,低用量から開始して,徐々に増量し,綿密なモニタリングを行う。ある文献では,GFRが10mL/分未満の場合は100mgを隔日投与する方法が提案されている |
| リチウム22, 23, 25, 32, 135, 136 |
リチウムには腎毒性があるため,重度腎機能障害がある場合は禁忌である。95%が未変化体として尿中に排泄される。長期投与により腎機能障害(“creatinine creep”),腎組織の永続的な変化,小嚢腫,オンコサイトーマ,腎集合管癌,腎性尿崩症,ネフローゼ症候群,可逆的・不可逆的な腎障害が生じることがある137,138。しかし,若年者の患者集団を対象としたより短期間の研究では,GFRの低下139または末期腎疾患の発現19は示されなかった。それらの違いは,方法の違いや,モニタリングの改善,推奨される維持血清中濃度(双極性感情障害では0.6-0.8mmol/L)を目標とすることによると考えられる 慢性腎臓病を防ぐために,1日1回の投与,血漿中濃度の推奨,中毒の回避,積極的な腎機能のモニタリングを行い,慢性腎臓病が生じた場合は精神科医,腎臓病専門医と患者が共同で投与継続についての意思決定を行う140 リチウム誘発性腎毒性の危険因子は,加齢,投与期間,蓄積量,初回eGFR低値,女性,高血圧,糖尿病,腎毒性のある薬の併用,腎性尿崩症,リチウム毒性の既往などがある141 腎機能障害でリチウムを投与すると毒性が現れやすくなり,リチウムによる毒性は腎機能障害のリスクを増加させる。急性毒性よりも慢性毒性による腎障害の可能性が高い。製薬会社は,腎機能障害でのリチウムの投与は禁忌としている。用量:GFRが10-50mL/分の場合は使用しないか,投与量を減らし(通常量の50-75%),血中濃度をモニタリングする。10mL/分未満の場合は,可能なら使用しないが,使用する場合は必ず用量を減らす(通常量の25-50%)。血液透析例で問題なく使用された症例報告が1件ある142 |
| バルプロ酸22, 23, 25, 143-149 | 未変化体として排泄されるのは約2%である。通常,腎機能障害がある場合でも用量を調節する必要はないが,遊離バルプロ酸濃度が上昇する可能性がある。腎機能障害,間質性腎炎,ファンコニー症候群,腎尿細管アシドーシス,腎不全が報告されている。腎尿細管機能障害の危険因子には,寝たきり状態,血清カルニチン濃度低下,血清リン濃度低下などがある150。投与は腎機能が正常な場合と同様に行うが,重度腎機能障害(GFRが10mL/分未満)の場合は,遊離(非結合型)バルプロ酸の濃度に応じて用量を調節する必要があることがある。双極性障害例において慢性腎臓病を引き起こす可能性はおそらくリチウムよりも低いようであるが151,データは相反している152 |
表8.11 腎機能障害がある場合の抗不安薬および催眠薬
| 薬剤 | コメント |
| buspirone22, 23, 25, 32 | 未変化体として排泄されるのは1%未満であるが,活性代謝産物が腎から排泄される。用量に関して一致した見解は得られていないが,次のように提案されている:GFRが10-50mL/分の場合は低用量で開始し,1日2回投与する。10mL/分未満の場合は,活性代謝産物が蓄積するため,できれば使用しない。無尿症患者への投与が必要な場合は,投与量を25-50%減量する。製薬会社は,重度腎機能障害への投与は禁忌としている |
| クロルジアゼポキシド23, 25, 32 | 1-2%が未変化体として排泄されるが,長時間作用が持続する活性代謝産物があり,蓄積する可能性がある。用量:GFRが10-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが10mL/分未満の場合,用量を50%減量する。過度の鎮静が生じないようモニタリングすること。製薬会社は,慢性腎臓病の場合は慎重に投与するよう推奨している |
|
clomethiazole 22, 23, 25, 153 (chlormethiazole) |
未変化体として尿中に排泄されるのは0.1-5%である。投与は腎機能が正常な場合と同様に行うが,過度の鎮静が生じないようモニタリングする。製薬会社は,腎疾患では慎重に投与するよう推奨している |
| クロナゼパム22, 23, 25, 154 | 未変化体として尿中に排泄されるのは0.5%未満である。腎機能障害があっても用量を調節する必要はないが,長期投与により活性代謝産物が蓄積する可能性があるため,低用量から開始し,反応に応じて増量する。過度の鎮静が生じないようモニタリングすること。血液透析例の不眠症に使用されている |
| ジアゼパム22, 25, 32, 155 | 未変化体として排泄されるのは0.5%未満である。用量:GFRが20-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが20mL/分未満の場合は少量を投与し,反応に応じて増量する。腎機能障害があると,長時間作用が持続する活性代謝産物が蓄積するため,過度の鎮静や脳症が生じないようモニタリングすること。本剤の投与を受けた慢性腎不全1例で間質性腎炎が報告されている |
| エスゾピクロン156 | 10%未満が未変化体として尿中に排泄される。腎機能障害でも用量を調節する必要はない |
| ガバペンチン | 100%が未変化体として尿中に排泄され,腎機能障害の場合はクリアランスが低下するため血漿中濃度が上昇し,半減期が長くなる157。この結果,用量を減少させなければ,腎機能障害患者では毒性が生じるおそれがある158。血液透析を受けている患者の下肢静止不能,掻痒,神経障害性疼痛の治療に使用したとき,急性腎不全159,ミオクローヌス160,意識障害,転倒,骨折が報告されている161,162。RCTでは,血液透析患者の掻痒症,筋痙攣,下肢静止不能症候群の治療に用いられている163-165。用量に関して一致した見解は得られていないが,次のように提案されている:GFRが15-60mL/分の場合は低用量で開始し,反応に応じて増量する。GFRが15mL/分未満の場合は300mgを隔日投与32,159または夜に100mg投与し,忍容性に応じて増量するが25,166,上述の毒性が生じていないか注意する。製薬会社はSMPCに腎機能障害例に対する具体的な投与量の表を記載している159 |
| レンボレキサント41, 167 | 未変化体として排泄されるのは1%未満である。製薬会社は,腎機能障害の場合も用量調節は必要ないとしているが,重度の腎機能障害例では曝露量が増加し,傾眠リスク増大の可能性があるとしている |
| ロラゼパム22, 23, 25, 32, 168-173 | 未変化体として尿中に排泄されるのは1%未満である。投与は腎機能が正常な場合と同様に行うが,場合によっては投与量の減量が必要なこともあるので,反応に応じて慎重に投与する。過度の鎮静が生じないようモニタリングすること。重度腎機能障害2例で薬物排泄の障害,さらにロラゼパム注射剤に含まれるプロピレングリコールによる腎機能障害や急性尿細管壊死が報告されている。一方,注射剤を緊張病の腎不全2例に投与し,治療に成功した報告もある |
| ニトラゼパム23, 25 | 未変化体として尿中に排泄されるのは5%未満である。用量:GFRが10-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが10mL/分未満の場合は少量から開始し,徐々に増量する。製薬会社は,腎機能障害では投与量を減らすよう推奨している。鎮静およびふらつきの有無をモニタリングすること |
| プレガバリン | 最大99%が未変化体として尿中に排泄される。急性腎不全の報告がある174。血液透析を受けている症例161に使用した場合,意識障害および転倒,またミオクローヌスとも関連する175。慢性腎臓病患者において突然の中止後けいれん発作が生じた症例報告がある176。血液透析を受けている症例の尿毒症性掻痒症および神経障害性疼痛の治療に用いられている177,178。用量に関して一致した見解は得られていないが,次のように提案されている:いずれのGFRでも忍容性および反応によって用量を徐々に増やすこと。GFRが30-60mL/分の場合は75mg/日,GFRが15-30mL/分の場合25-50mg/日,GFRが15mL/分未満の場合25mg/日。製薬会社はSMPCに腎機能障害例に対する具体的な投与量の表を記載している174 |
| oxazepam22, 25, 32, 179 | 未変化体として尿中に排泄されるのは1%未満である。重度の腎機能障害がある場合は,用量調節が必要である。また腎機能障害例では,定常状態に達するまでの時間が長くなることがある。用量:GFRが10-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが10mL/分未満の場合は低用量から開始し,反応に応じて増量する。過度の鎮静が生じないようモニタリングすること |
| プロメタジン 22, 23, 25, 32, 180 | 通常,投与量を減らす必要はないが,半減期が長いため,腎機能障害患者に投与する場合は過度の鎮静作用が生じないようモニタリングする。製薬会社は,腎機能障害では慎重に投与するよう推奨している。プロメタジン代謝能が低い患者で間質性腎炎の症例報告がある |
| temazepam22, 23, 25, 32 | 未変化体として尿中に排泄されるのは2%未満である。腎機能障害があると,不活性代謝産物が蓄積する可能性がある。過度の鎮静作用が生じないようモニタリングすること。用量:GFRが20-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが20mL/分未満の場合も腎機能が正常な場合と同様に投与するが,5mgから開始する |
| ゾルピデム22, 23, 25, 154, 181 | 腎機能障害ではクリアランスがやや低下する。腎機能障害では用量を調節する必要はない。血液透析例の不眠症を治療するために,ゾルピデム1mgが使用されている。掻痒症を有する血液透析例の睡眠補助のためのゾルピデムを検討するRCTが進行中である182。女性では急性腎盂腎炎と関連がある183 |
| ゾピクロン22, 23, 25, 184, 185 | 未変化体として尿中に排泄されるのは5%未満である。製薬会社は,腎機能障害があっても本剤が蓄積することはないが,開始量を3.75mgとすることを推奨している。用量:GFRが10mL/分未満の場合は低用量から開始する。間質性腎炎の報告は稀である |
GFR:糸球体濾過量,SMPC:製品概要 , SSRI:選択的セロトニン再取り込み阻害薬
表8.12 腎機能障害がある場合の抗認知症薬
| 薬剤 | コメント |
| ドネペジル23, 25, 186-188 | 17%が未変化体として尿中に排泄される。用量:GFRが10-50mL/分未満の場合,腎機能が正常な場合と同様に投与する。製薬会社は,クリアランスは腎機能障害の影響を受けないと述べている。中等度および重度の腎機能障害例の単回投与試験で,薬物動態は健常対照被験者と同様であった。アルツハイマー型認知症の高齢透析例に3mg/日の投与量で使用されている。横紋筋融解症が急性腎不全をもたらした単発の症例報告がある189 |
| ガランタミン23, 25 | 18-22%が未変化体として尿中に排泄される。GFRが10-50mL/分の場合は腎機能が正常な場合と同様に投与する。GFRが10mL/分未満の場合は低用量から開始し,徐々に増量する。製薬会社は,GFRが10mL/分未満の場合の使用を禁忌としている。中等度および重度の腎機能障害例では血漿中濃度が上昇することがある |
| メマンチン22, 23, 190 | 製薬会社は,GFRが5-29mL/分の場合は投与量を10mgとし,GFRが30-49mL/分を超える場合は1日1回10mgを7日間投与し,忍容性に問題がなかった場合には20mg/日に増量するように推奨している。尿細管性アシドーシス,重度の尿路感染症,尿アルカリ化(急激な食事の変化等による)により血漿中メマンチン濃度が上昇することがある。本剤投与に伴う急性腎不全の報告がある |
| リバスチグミン23, 25 | 尿中に排泄される未変化体はない。用量:GFRが50mL/分未満の場合,低用量から開始し,徐々に増量する。定常状態における血漿中濃度は腎機能の影響を受けない191 |
GFR:糸球体濾過量,RCT:無作為化比較試験
表8.13 腎機能障害がある場合のその他の向精神薬
| 薬剤 | コメント |
| bremelanotide 41, 192 | 64.8%が未変化体として尿中に排泄される。製薬会社はGFRが30-89mL/分の場合,用量調節は必要ないが,30mL/分未満の場合は,副作用が増大するおそれがあるため,慎重投与を推奨している。腎機能障害がある場合は曝露量が増加する。melanotan II(bremelanotideはmelanotan IIの活性代謝物)使用に伴う横紋筋融解症と腎機能障害の症例報告がある193 |
| deutetrabenazine 194 | 腎機能障害例に対する臨床試験は行われていない。データが限られており,具体的な用量の推奨はない |
| pitolisant 41, 195 | 2%未満が未変化体として尿中に排泄される。用量:GFRが15-59mL/分の場合は9mg/日,7日後最大18mg1日1回まで増量する196。GFRが15mL/分未満の場合,使用は推奨されない196。腎機能障害の場合は重症度にかかわらず,最高濃度と曝露量が増大する |
| prucalopride 41 | 60-65%が未変化体として尿中に排泄される。用量:GFRが30mL/分以上の場合,用量調節は必要ない。GFRが30mL/分未満の場合は1mg/日。製薬会社は透析例には禁忌としている。中等度および重度の腎機能障害がある場合は曝露量が増加し197,腎機能障害の場合は重症度にかかわらず血漿中濃度が上昇する198。本剤使用に伴う急性尿細管壊死および急性腎不全の症例報告がある199 |
| solriamfetol 41, 200 | 95%が未変化体として尿中に排泄される。用量:GFRが60-89mL/分の場合,用量調節は必要ない。GFRが30-59mL/分の場合は37.5mg1日1回,5日後に最大75mg1日1回へ増量する。GFRが15-29mL/分の場合は5mg1日1回,GFRが15mL/分未満の場合は使用しないことが推奨される。中等度から重度の腎機能障害の場合,半減期の延長により血圧および心拍数の上昇リスクがある。腎機能障害は重症度にかかわらず,特に末期腎不全では曝露量が増大し半減期も延長する201 |
| valbenazine 41 | 2%未満が未変化体として尿中に排泄される。軽度から中等度の腎機能障害におけるGFRが30-90mL/分の場合,用量調節は必要ない。製薬会社はGFRが30mL/分未満の重度腎機能障害の場合は使用しないよう推奨している202。臨床試験では副作用として尿閉が報告されている |
要約─腎機能障害がある場合に推奨される向精神薬
薬物療法中に腎機能が低下した場合,既存の薬剤が腎機能低下の原因から除外されたら,表8.8-8.13に提示した用量で継続する。新規薬剤の投与が必要である場合,以下の表に従う。
| 薬剤群 | 推奨される薬剤 |
| 抗精神病薬 |
|
| 抗うつ薬203 |
|
| 気分安定薬 |
|
| 抗不安薬および催眠薬 |
|
| 抗認知症薬 |
|
CBT:認知行動療法,GFR:糸球体濾過量 , SSRI:選択的セロトニン再取り込み阻害薬
(高橋 希衣)
参照文献
- National Institute for Clinical Excellence. 4-year surveillance (2017) – Chronic kidney disease in adults (2014) NICE guideline [CG182]; https://www.nice.org.uk/guidance/cg182/evidence/appendix-a2-cg182-summary-of-new-evidence-from-surveillance-pdf-4429248447.
- Levey AS, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009; 150:604–612.
- National Institute for Health and Care Excellence. Chronic kidney disease in adults: assessment and management. Clinical Guidance 182 [CG182] 2015; https://www.nice.org.uk/guidance/cg182.
- National Institute for Clinical Excellence. Surveillance report 2017 – Chronic kidney disease (stage 4 or 5): management of hyperphosphataemia (2013) NICE Guideline CG157. Chronic kidney disease in adults: as - sessment and management (2014) NICE guideline CG182 and Chronic kidney disease: managing anae - mia (2015) NICE guideline NG8 2017; https://www.nice.org.uk/guidance/cg182/resources/surveillance-report2017-chronic-kidney-disease-stage-4-or-5-management-of-hyperphosphataemia-2013-nice-guideline-cg157-chronic-kidney-disease-inadults-assessment-and-management-2014-nice-guideline–pdf-5740305984709.
- Tangri N, et al. A predictive model for progression of chronic kidney disease to kidney failure. JAMA 2011; 305:1553–1559.
- Brater DC. Measurement of renal function during drug development. Br J Clin Pharmacol 2002; 54:87–95.
- Chinnadurai R, et al. Impact of chronic kidney disease on the drugs eliminated predominantly through a non-renal route: a proof of concept study with Citalopram. Nephrol Dial Transplant 2019; 34:gfz103.SP268.
- Toprak O, et al. New-onset type II diabetes mellitus, hyperosmolar non-ketotic coma, rhabdomyolysis and acute renal failure in a patient treated with sulpiride. Nephrol Dial Transplant 2005; 20:662–663.
- Baumgart U, et al. Olanzapine-induced acute rhabdomyolysis – a case report. Pharmacopsychiatry 2005; 38:36–37.
- Marsh SJ, et al. Rhabdomyolysis and acute renal failure during high-dose haloperidol therapy. Ren Fail 1995; 17:475–478.
- Smith RP, et al. Quetiapine overdose and severe rhabdomyolysis. J Clin Psychopharmacol 2004; 24:343.
- Nagler EV, et al. Antidepressants for depression in stage 3-5 chronic kidney disease: a systematic review of pharmacokinetics, efficacy and safety with recommendations by European Renal Best Practice (ERBP). Nephrol Dial Transplant 2012; 27:3736–3745.
- Palmer SC, et al. Antidepressants for treating depression in adults with end-stage kidney disease treated with dialysis. The Cochrane Database of Systematic Reviews 2016:CD004541.
- Dev V, et al. Higher anti-depressant dose and major adverse outcomes in moderate chronic kidney disease: a retrospective populationbased study. BMC Nephrol 2014; 15:79.
- Guirguis A, et al. Antidepressant usage in haemodialysis patients: evidence of sub-optimal practice patterns. J Ren Care 2020; 46:124–132.
- Natale P, et al. Psychosocial interventions for preventing and treating depression in dialysis patients. Cochrane Database of Systematic Reviews 2019; CD004542.
- Vangala C, et al. Selective serotonin reuptake inhibitor use and hip fracture risk among patients on hemodialysis. Am J Kidney Dis 2020; 75:351–360.
- Tzeng NS, et al. Is schizophrenia associated with an increased risk of chronic kidney disease? A nationwide matched cohort study. BMJ Open 2015; 5:e006777.
- Kessing LV, et al. Use of lithium and anticonvulsants and the rate of chronic kidney disease: a nationwide population-based study. JAMA Psychiatry 2015; 72:1182–1191.
- Jiang Y, et al. A retrospective cohort study of acute kidney injury risk associated with antipsychotics. CNS Drugs 2017; 31:319–326.
- Ryan PB, et al. Atypical antipsychotics and the risks of acute kidney injury and related outcomes among older adults: a replication analysis and an evaluation of adapted confounding control strategies. Drugs Aging 2017; 34:211–219.
- Truven Health Analytics. Micromedex 2.0. 2017; https://www.micromedexsolutions.com/home/dispatch.
- Datapharm Ltd. Electronic Medicines Compendium 2020; https://www.medicines.org.uk/emc.
- Noble S, et al. Amisulpride: a review of its clinical potential in dysthymia. CNS Drugs 1999; 12:471–483.
- Taylor & Francis Group. Renal Drug Database 2020; https://renaldrugdatabase.com.
- Aragona M. Tolerability and efficacy of aripiprazole in a case of psychotic anorexia nervosa comorbid with epilepsy and chronic renal failure. Eat Weight Disord 2007; 12:e54–e57.
- Mallikaarjun S, et al. Effects of hepatic or renal impairment on the pharmacokinetics of aripiprazole. Clin Pharmacokinet 2008; 47:533–542.
- Tzeng NS, et al. Delusional parasitosis in a patient with brain atrophy and renal failure treated with aripiprazole: case report. Prog Neuropsychopharmacol Biol Psychiatry 2010; 34:1148–1149.
- De Donatis D, et al. Serum aripiprazole concentrations prehemodialysis and posthemodialysis in a schizophrenic patient with chronic renal failure: a case report. J Clin Psychopharmacol 2020; 40:200–202.
- Peeters P, et al. Asenapine pharmacokinetics in hepatic and renal impairment. Clin Pharmacokinet 2011; 50:471–481.
- Fabre J, et al. Influence of renal insufficiency on the excretion of chloroquine, phenobarbital, phenothiazines and methacycline. Helv Med Acta 1967; 33:307–316.
- Aronoff GR, et al. Drug Prescribing in Renal Failure: Dosing Guidelines for Adults and Children. 5th edn. Philadelphia: American College of Physicians; 2007.
- Fraser D, et al. An unexpected and serious complication of treatment with the atypical antipsychotic drug clozapine. Clin Nephrol 2000; 54:78–80.
- Au AF, et al. Clozapine-induced acute interstitial nephritis. Am J Psychiatry 2004; 161:1501.
- Elias TJ, et al. Clozapine-induced acute interstitial nephritis. Lancet 1999; 354:1180–1181.
- Siddiqui BK, et al. Simultaneous allergic interstitial nephritis and cardiomyopathy in a patient on clozapine. NDT Plus 2008; 1:55–56.
- Davis EAK, et al. Clozapine-associated renal failure: a case report and literature review. Ment Health Clin 2019; 9:124–127.
- Lim AM, et al. Clozapine, immunosuppressants and renal transplantation. Asian J Psychiatr 2016; 23:118.
- Lobeck F, et al. Haloperidol concentrations in an elderly patient with moderate chronic renal failure. J Geriatr Drug Ther 1986; 1:91–97.
- Cohen LM, et al. Update on psychotropic medication use in renal disease. Psychosomatics 2004; 45:34–48.
- Lendac Data Systems Ltd. Drugdex Systems 2020; https://www.drugdiscoveryonline.com/doc/drugdex-system-0001.
- Intra-Cellular Therapies Inc. Highlights of prescribing information. Caplyta (lumateperone) capsules for oral use 2019; https://www. accessdata.fda.gov/drugsatfda_docs/label/2019/209500s000lbl.pdf.
- Sunovion Pharmaceuticals Europe Ltd. Summary of Product Characteristics. Latuda 18.5mg, 37mg and 74mg film-coated tablets 2020; https://www.medicines.org.uk/emc/medicine/29125.
- Kansagra A, et al. Prolonged hypothermia due to olanzapine in the setting of renal failure: a case report and review of the literature. Ther Adv Psychopharmacol 2013; 3:335–339.
- Samalin L, et al. Interest of clozapine and paliperidone palmitate plasma concentrations to monitor treatment in schizophrenic patients on chronic hemodialysis. Schizophr Res 2015; 166:351–352.
- ACADIA Pharmaceuticals Inc. Highlights of prescribing information. Nuplazid (pimavanserin) tablets for oral use 2020; https://www.accessdata.fda.gov/drugsatfda_docs/label/2016/207318lbl.pdf.
- Thyrum PT, et al. Single-dose pharmacokinetics of quetiapine in subjects with renal or hepatic impairment. Prog Neuropsychopharmacol Biol Psychiatry 2000; 24:521–533.
- Huynh M, et al. Thrombotic thrombocytopenic purpura associated with quetiapine. Ann Pharmacother 2005; 39:1346–1348.
- Torroba Sanz B, et al. Permanent renal sequelae secondary to drug reaction with eosinophilia and systemic symptoms (DRESS) syndrome induced by quetiapine. Eur J Hosp Pharm 2020:[Epub ahead of print].
- Snoeck E, et al. Influence of age, renal and liver impairment on the pharmacokinetics of risperidone in man. Psychopharmacology (Berl) 1995; 122:223–229.
- Herguner S, et al. Steroid-induced psychosis in an adolescent: treatment and prophylaxis with risperidone. Turk J Pediatr 2006; 48:244–247.
- Batalla A, et al. Antipsychotic treatment in a patient with schizophrenia undergoing hemodialysis. J Clin Psychopharmacol 2010; 30:92–94.
- Tourtellotte R, et al. Use of therapeutic drug monitoring of risperidone microspheres long-acting injection in hemodialysis: a case report. Ment Health Clin 2019; 9:404–407.
- Bressolle F, et al. Pharmacokinetics of sulpiride after intravenous administration in patients with impaired renal function. Clin Pharmacokinet 1989; 17:367–373.
- Aweeka F, et al. The pharmacokinetics of ziprasidone in subjects with normal and impaired renal function. Br J Clin Pharmacol 2000; 49:27S-33S.
- Roerig. Highlights of Prescribing Information: GEODON® (ziprasidone HCl) capsules; GEODON® (ziprasidone mesylate) injection for intramuscular use 2020; http://labeling.pfizer.com/ShowLabeling.aspx?id=584.
- Iskandar JW, et al. Transient agranulocytosis associated with ziprasidone in a 45-year-old man on hemodialysis. J Clin Psychopharmacol 2015; 35:347–348.
- Basol N, et al. Beneficial effects of agomelatine in experimental model of sepsis-related acute kidney injury. Ulus Travma Acil Cerrahi Derg 2016; 22:121–126.
- Karaman A, et al. A novel approach to contrast-induced nephrotoxicity: the melatonergic agent agomelatine. Br J Radiol 2016; 89:20150716.
- Lieberman JA, et al. Tricyclic antidepressant and metabolite levels in chronic renal failure. Clin Pharmacol Ther 1985; 37:301–307.
- Mitas JA, et al. Diabetic neuropathic pain: control by amitriptyline and fluphenazine in renal insufficiency. South Med J 1983; 76:462–463, 467.
- Murphy EJ. Acute pain management pharmacology for the patient with concurrent renal or hepatic disease. Anaesth Intensive Care 2005; 33:311–322.
- Constantino JL, et al. Pharmacokinetics of antidepressants in patients undergoing hemodialysis: a narrative literature review. Braz J Psychiatry 2019; 41:441–446.
- Chen TY, et al. Amitriptyline-induced acute kidney injury and acute hepatitis: a case report. Am J Ther 2021; 28:e256-e258
- Sage Therapeutics Inc. Highlights of Prescribing Information. Zulresso (brexanolone) injection for intravenous use [controlled substance schedule pending] 2019; https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/211371lbl.pdf.
- Turpeinen M, et al. Effect of renal impairment on the pharmacokinetics of bupropion and its metabolites. Br J Clin Pharmacol 2007; 64:165–173.
- Worrall SP, et al. Pharmacokinetics of bupropion and its metabolites in haemodialysis patients who smoke. A single dose study. Nephron Clin Pract 2004; 97:c83–c89.
- Ghoreishi A, et al. Bupropion as a treatment for sexual dysfunction among chronic kidney disease patients Acta Med Iran 2019; 57:320– 327.
- Joffe P, et al. Single-dose pharmacokinetics of citalopram in patients with moderate renal insufficiency or hepatic cirrhosis compared with healthy subjects. Eur J Clin Pharmacol 1998; 54:237–242.
- Kalender B, et al. Antidepressant treatment increases quality of life in patients with chronic renal failure. Ren Fail 2007; 29:817–822.
- Kelly CA, et al. Adult respiratory distress syndrome and renal failure associated with citalopram overdose. Hum Exp Toxicol 2003; 22:103–105.
- Spigset O, et al. Citalopram pharmacokinetics in patients with chronic renal failure and the effect of haemodialysis. Eur J Clin Pharmacol 2000; 56:699–703.
- Hosseini SH, et al. Citalopram versus psychological training for depression and anxiety symptoms in hemodialysis patients. Iran J Kidney Dis 2012; 6:446–451.
- Sran H, et al. Confusion after starting citalopram in a renal transplant patient. BMJ Case Rep 2013; 2013:bcr2013010511.
- Assimon MM, et al. Comparative cardiac safety of selective serotonin reuptake inhibitors among individuals receiving maintenance hemodialysis. J Am Soc Nephrol 2019; 30:611–623.
- Onishi A, et al. Reversible acute renal failure associated with clomipramine-induced interstitial nephritis. Clin Exp Nephrol 2007; 11:241– 243.
- Wyeth Pharmaceuticals Inc. Highlights of Prescribing Information. PRISTIQ® (desvenlafaxine) Extended-Release Tablets, for oral use 2020; http://labeling.pfizer.com/showlabeling.aspx?id=497%20.
- Nichols AI, et al. The pharmacokinetics and safety of desvenlafaxine in subjects with chronic renal impairment. Int J Clin Pharmacol Ther 2011; 49:3–13.
- Rees JA. Clinical interpretation of pharmacokinetic data on dothiepin hydrochloride (Dosulepin, Prothiaden). J Int Med Res 1981; 9:98–102.
- Swarna SS, et al. Pruritus associated with chronic kidney disease: a comprehensive literature review. Cureus 2019; 11:e5256.
- Lobo ED, et al. Effects of varying degrees of renal impairment on the pharmacokinetics of duloxetine: analysis of a single-dose phase I study and pooled steady-state data from phase II/III trials. Clin Pharmacokinet 2010; 49:311–321.
- Ho NV, et al. Duloxetine-induced multi-system organ failure: a case report. Poster presented at American Geriatrics Society Annual Meeting, May 11–15, 2011: National Harbor, Maryland; 2011.
- Nguyen T, et al. Duloxetine uses in patients with kidney disease: different recommendations from the United States versus Europe and Canada. Am J Ther 2019; 26:e516-e519.
- Uong C, et al. Poster 91 serotonin syndrome in chronic kidney disease patient after given a dose of duloxetine while on trazodone: a case report. PM&R 2014; 6(Suppl): S214–S215.
- Miriyala K, et al. Renal failure in a depressed adolescent on escitalopram. J Child Adolesc Psychopharmacol 2008; 18:405–408.
- Adiga GU, et al. Renal tubular defects from antidepressant use in an older adult: an uncommon but reversible adverse drug effect. Clin Drug Invest 2006; 26:607–610.
- Yazici AE, et al. Efficacy and tolerability of escitalopram in depressed patients with end stage renal disease: an open placebo-controlled study. Bull Clin Psychopharmacol 2012; 22:23–30.
- Bergstrom RF, et al. The effects of renal and hepatic disease on the pharmacokinetics, renal tolerance, and risk-benefit profile of fluoxetine. Int Clin Psychopharmacol 1993; 8:261–266.
- Blumenfield M, et al. Fluoxetine in depressed patients on dialysis. Int J Psychiatry Med 1997; 27:71–80.
- Levy NB, et al. Fluoxetine in depressed patients with renal failure and in depressed patients with normal kidney function. Gen Hosp Psychiatry 1996; 18:8–13.
- Kauffman KM, et al. Higher dose weekly fluoxetine in hemodialysis patients: a case series report. Int J Psychiatry Med 2020; 56:3–13.
- Lancaster SG, et al. Lofepramine. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic efficacy in depressive illness. Drugs 1989; 37:123–140.
- Davis MP, et al. Mirtazapine for pruritus. J Pain Symptom Manage 2003; 25:288–291.
- Shibata K, et al. SP704 The effect of mirtazapine in dialysis patient with appetite loss. Nephrol Dial Transplant 2015; 30(Suppl 3):iii611.
- Schoerlin MP, et al. Disposition kinetics of moclobemide, a new MAO-A inhibitor, in subjects with impaired renal function. J Clin Pharmacol 1990; 30:272–284.
- Stoeckel K, et al. Absorption and disposition of moclobemide in patients with advanced age or reduced liver or kidney function. Acta Psychiatr Scand Suppl 1990; 360:94–97.
- Pollock BG, et al. Metabolic and physiologic consequences of nortriptyline treatment in the elderly. Psychopharmacol Bull 1994; 30:145– 150.
- Doyle GD, et al. The pharmacokinetics of paroxetine in renal impairment. Acta Psychiatr Scand Suppl 1989; 350:89–90.
- Ishii T, et al. A rare case of combined syndrome of inappropriate antidiuretic hormone secretion and Fanconi syndrome in an elderly woman. Am J Kidney Dis 2006; 48:155–158.
- Kaye CM, et al. A review of the metabolism and pharmacokinetics of paroxetine in man. Acta Psychiatr Scand Suppl 1989; 350:60–75.
- Koo JR, et al. Treatment of depression and effect of antidepression treatment on nutritional status in chronic hemodialysis patients. Am J Med Sci 2005; 329:1–5.
- Coulomb F, et al. Pharmacokinetics of single-dose reboxetine in volunteers with renal insufficiency. J Clin Pharmacol 2000; 40:482–487.
- Dostert P, et al. Review of the pharmacokinetics and metabolism of reboxetine, a selective noradrenaline reuptake inhibitor. Eur Neuropsychopharmacol 1997; 7(Suppl 1):S23–S35.
- Brewster UC, et al. Addition of sertraline to other therapies to reduce dialysis-associated hypotension. Nephrology (Carlton) 2003; 8:296– 301.
- Chan KY, et al. Use of sertraline for antihistamine-refractory uremic pruritus in renal palliative care patients. J Palliat Med 2013; 16:966–970.
- Chander WP, et al. Serotonin syndrome in maintenance haemodialysis patients following sertraline treatment for depression. J Indian Med Assoc 2011; 109:36–37.
- Jain N, et al. Rationale and design of the Chronic Kidney Disease Antidepressant Sertraline Trial (CAST). Contemp Clin Trials 2013; 34:136–144.
- Hedayati SS, et al. Effect of sertraline on depressive symptoms in patients with chronic kidney disease without dialysis dependence: the CAST randomized clinical trial. JAMA 2017; 318:1876–1890.
- Razeghi E, et al. A randomized crossover clinical trial of sertraline for intradialytic hypotension. Iran J Kidney Dis 2015; 9:323–330.
- Mehrotra R, et al. Comparative efficacy of therapies for treatment of depression for patients undergoing maintenance hemodialysis: a randomized clinical trial. Ann Intern Med 2019; 170:369–379.
- Friedli K, et al. Sertraline versus placebo in patients with major depressive disorder undergoing hemodialysis: a randomized, controlled feasibility trial. Clin J Am Soc Nephrol 2017; 12:280–286.
- Chien CW, et al. Sertraline-induced neutropenia and fatigue in a patient with end-stage renal disease. Am J Ther 2020:[Epub ahead of print].
- Zahed NS, et al. Impact of sertraline on serum concentration of CRP in hemodialysis patients with depression. J Renal Inj Prev 2017; 6:65–69.
- Gregg LP, et al. Inflammation and response to sertraline treatment in patients with CKD and major depression. Am J Kidney Dis 2020; 75:457–460.
- Catanese B, et al. A comparative study of trazodone serum concentrations in patients with normal or impaired renal function. Boll Chim Farm 1978; 117:424–427.
- Leighton JD, et al. Trimipramine-induced acute renal failure (Letter). N Z Med J 1986; 99:248.
- Simpson GM, et al. A preliminary study of trimipramine in chronic schizophrenia. Curr Ther Res Clin Exp 1966; 99:248.
- Troy SM, et al. The effect of renal disease on the disposition of venlafaxine. Clin Pharmacol Ther 1994; 56:14–21.
- Guldiken S, et al. Complete relief of pain in acute painful diabetic neuropathy of rapid glycaemic control (insulin neuritis) with venlafaxine HCL. Diabetes Nutr Metab 2004; 17:247–249.
- Pascale P, et al. Severe rhabdomyolysis following venlafaxine overdose. Ther Drug Monit 2005; 27:562–564.
- Takeda Pharmaceuticals America Inc. Highlights of Prescribing Information. BRINTELLIX (vortioxetine) tablets 2020; http://www.us.brintellix.com.
- Hegarty J, et al. Carbamazepine-induced acute granulomatous interstitial nephritis. Clin Nephrol 2002; 57:310–313.
- Hogg RJ, et al. Carbamazepine-induced acute tubulointerstitial nephritis. J Pediatr 1981; 98:830–832.
- Imai H, et al. Carbamazepine-induced granulomatous necrotizing angiitis with acute renal failure. Nephron 1989; 51:405–408.
- Jubert P, et al. Carbamazepine-induced acute renal failure. Nephron 1994; 66:121.
- Nicholls DP, et al. Acute renal failure from carbamazepine (Letter). Br Med J 1972; 4:490.
- Tutor-Crespo MJ, et al. Relative proportions of serum carbamazepine and its pharmacologically active 10,11-epoxy derivative: effect of polytherapy and renal insufficiency. Ups J Med Sci 2008; 113:171–180.
- Verrotti A, et al. Renal tubular function in patients receiving anticonvulsant therapy: a long-term study. Epilepsia 2000; 41:1432–1435.
- Hung CC, et al. Acute renal failure and its risk factors in Stevens-Johnson syndrome and toxic epidermal necrolysis. Am J Nephrol 2009; 29:633–638.
- Fervenza FC, et al. Acute granulomatous interstitial nephritis and colitis in anticonvulsant hypersensitivity syndrome associated with lamotrigine treatment. Am J Kidney Dis 2000; 36:1034–1040.
- Fillastre JP, et al. Pharmacokinetics of lamotrigine in patients with renal impairment: influence of haemodialysis. Drugs Exp Clin Res 1993; 19:25–32.
- Schaub JE, et al. Multisystem adverse reaction to lamotrigine. Lancet 1994; 344:481.
- Wootton R, et al. Comparison of the pharmacokinetics of lamotrigine in patients with chronic renal failure and healthy volunteers. Br J Clin Pharmacol 1997; 43:23–27.
- Bansal AD, et al. Use of antiepileptic drugs in patients with chronic kidney disease and end stage renal disease. Seminars in Dialysis 2015; 28:404–412.
- Gitlin M. Lithium and the kidney: an updated review. Drug Saf 1999; 20:231–243.
- Lepkifker E, et al. Renal insufficiency in long-term lithium treatment. J Clin Psychiatry 2004; 65:850–856.
- McKnight RF, et al. Lithium toxicity profile: a systematic review and meta-analysis. Lancet 2012; 379:721–728.
- Shine B, et al. Long-term effects of lithium on renal, thyroid, and parathyroid function: a retrospective analysis of laboratory data. Lancet 2015; 386:461–468.
- Clos S, et al. Long-term effect of lithium maintenance therapy on estimated glomerular filtration rate in patients with affective disorders: a population-based cohort study. Lancet Psychiatry 2015; 2:1075–1083.
- Schoot TS, et al. Systematic review and practical guideline for the prevention and management of the renal side effects of lithium therapy. Eur Neuropsychopharmacol 2020; 31:16–32.
- Davis J, et al. Lithium and nephrotoxicity: a literature review of approaches to clinical management and risk stratification. BMC Nephrol 2018; 19:305.
- Engels N, et al. Successful lithium treatment in a patient on hemodialysis. Bipolar Disorders 2019; 21:285–287.
- Smith GC, et al. Anticonvulsants as a cause of Fanconi syndrome. Nephrol Dial Transplant 1995; 10:543–545.
- Fukuda Y, et al. Immunologically mediated chronic tubulo-interstitial nephritis caused by valproate therapy. Nephron 1996; 72:328–329.
- Watanabe T, et al. Secondary renal Fanconi syndrome caused by valproate therapy. Pediatr Nephrol 2005; 20:814-817.
- Zaki EL, et al. Renal injury from valproic acid: case report and literature review. Pediatr Neurol 2002; 27:318–319.
- Tanaka H, et al. Distal type of renal tubular acidosis after anti-epileptic therapy in a girl with infantile spasms. Clin Exp Nephrol 1999; 3:311–313.
- Knorr M, et al. Fanconi syndrome caused by antiepileptic therapy with valproic acid. Epilepsia 2004; 45:868–871.
- Rahman MH, et al. Acute hemolysis with acute renal failure in a patient with valproic acid poisoning treated with charcoal hemoperfusion. Hemodial Int 2006; 10:256–259.
- Koga S, et al. Risk factors for sodium valproate-induced renal tubular dysfunction. Clin Exp Nephrol 2018; 22:420–425.
- Hayes JF, et al. Adverse renal, endocrine, hepatic, and metabolic events during maintenance mood stabilizer treatment for bipolar disorder: a population-based cohort study. PLoS Med 2016; 13:e1002058.
- Kessing LV, et al. Continuation of lithium after a diagnosis of chronic kidney disease. Acta Psychiatr Scand 2017; 136:615–622.
- Pentikainen PJ, et al. Pharmacokinetics of chlormethiazole in healthy volunteers and patients with cirrhosis of the liver. Eur J Clin Pharmacol 1980; 17:275–284.
- Dashti-Khavidaki S, et al. Comparing effects of clonazepam and zolpidem on sleep quality of patients on maintenance hemodialysis. Iran J Kidney Dis 2011; 5:404–409.
- Sadjadi SA, et al. Allergic interstitial nephritis due to diazepam. Arch Intern Med 1987; 147:579.
- Sunovion Pharmaceuticals Inc. Highlights of Prescribing Information. LUNESTA® (eszopiclone) tablets, for oral use 2020; https://www.accessdata.fda.gov/drugsatfda_docs/label/2014/021476s030lbl.pdf.
- Blum RA, et al. Pharmacokinetics of gabapentin in subjects with various degrees of renal function. Clin Pharmacol Ther 1994; 56:154–159.
- Miller A, et al. Gabapentin toxicity in renal failure: the importance of dose adjustment. Pain Med 2009; 10:190–192.
- Upjohn UK Limited. Summary of product characteristics. Neurontin 600mg film-coated tablets 2020; https://www.medicines.org.uk/emc/product/3197/smpc.
- Yeddi A, et al. Myoclonus and altered mental status induced by single dose of gabapentin in a patient with end-stage renal disease: a case report and literature review. Am J Ther 2019; 26:e768–e770.
- Ishida JH, et al. Gabapentin and pregabalin use and association with adverse outcomes among hemodialysis patients. J Am Soc Nephrol 2018; 29:1970–1978.
- Gobo-Oliveira M, et al. Gabapentin versus dexchlorpheniramine as treatment for uremic pruritus: a randomised controlled trial. Eur J Dermatol 2018; 28:488–495.
- Gunal AI, et al. Gabapentin therapy for pruritus in haemodialysis patients: a randomized, placebo-controlled, double-blind trial. Nephrol Dial Transplant 2004; 19:3137–3139.
- Beladi Mousavi SS, et al. The effect of gabapentin on muscle cramps during hemodialysis: a double-blind clinical trial. Saudi J Kidney Dis Transpl 2015; 26:1142–1148.
- Razazian N, et al. Gabapentin versus levodopa-c for the treatment of restless legs syndrome in hemodialysis patients: a randomized clinical trial. Saudi J Kidney Dis Transpl 2015; 26:271–278.
- Rossi GM, et al. Randomized trial of two after-dialysis gabapentin regimens for severe uremic pruritus in hemodialysis patients. Intern Emerg Med 2019; 14:1341–1346.
- Eisai Inc. Highlights of Prescribing Information. Dayvigo (lemborexant) tablets for oral use [controlled substance schedule pending] 2019; https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/212028s000lbl.pdf.
- Huang CE, et al. Intramuscular lorazepam in catatonia in patients with acute renal failure: a report of two cases. Chang Gung Med J 2010; 33:106–109.
- Reynolds HN, et al. Hyperlactatemia, increased osmolar gap, and renal dysfunction during continuous lorazepam infusion. Crit Care Med 2000; 28:1631–1634.
- Verbeeck RK, et al. Impaired elimination of lorazepam following subchronic administration in two patients with renal failure. Br J Clin Pharmacol 1981; 12:749–751.
- Yaucher NE, et al. Propylene glycol-associated renal toxicity from lorazepam infusion. Pharmacotherapy 2003; 23:1094–1099.
- Zar T, et al. Acute kidney injury, hyperosmolality and metabolic acidosis associated with lorazepam. Nat Clin Pract Nephrol 2007; 3:515–520.
- Hayman M, et al. Acute tubular necrosis associated with propylene glycol from concomitant administration of intravenous lorazepam and trimethoprim-sulfamethoxazole. Pharmacotherapy 2003; 23:1190–1194.
- Upjohn UK Limited. Lyrica 25mg 50mg 75mg 100mg 150mg 200mg 225mg and 300mg hard capsules 2020; https://www.medicines.org.uk/emc/product/10303/smpc.
- Desai A, et al. Gabapentin or pregabalin induced myoclonus: a case series and literature review. J Clin Neurosci 2019; 61:225–234.
- Du YT, et al. Seizure induced by sudden cessation of pregabalin in a patient with chronic kidney disease. BMJ Case Rep 2017; 2017:bcr2016219158.
- Foroutan N, et al. Comparison of pregabalin with doxepin in the management of uremic pruritus: a randomized single blind clinical trial. Hemodial Int 2017; 21:63–71.
- Otsuki T, et al. Efficacy and safety of pregabalin for the treatment of neuropathic pain in patients undergoing hemodialysis. Clin Drug Investig 2017; 37:95–102.
- Murray TG, et al. Renal disease, age, and oxazepam kinetics. Clin Pharmacol Ther 1981; 30:805–809.
- Leung N, et al. Acute kidney injury in patients with inactive cytochrome P450 polymorphisms. Ren Fail 2009; 31:749–752.
- Drover DR. Comparative pharmacokinetics and pharmacodynamics of short-acting hypnosedatives: zaleplon, zolpidem and zopiclone. Clin Pharmacokinet 2004; 43:227–238.
- Rehman IU, et al. A randomized controlled trial for effectiveness of zolpidem versus acupressure on sleep in hemodialysis patients having chronic kidney disease-associated pruritus. Medicine (Baltimore) 2018; 97:e10764.
- Hsu FG, et al. Use of zolpidem and risk of acute pyelonephritis in women: a population-based case–control study in Taiwan. J Clin Pharmacol 2017; 57:376–381.
- Goa KL, et al. Zopiclone. A review of its pharmacodynamic and pharmacokinetic properties and therapeutic efficacy as an hypnotic. Drugs 1986; 32:48–65.
- Hussain N, et al. Zopiclone-induced acute interstitial nephritis. Am J Kidney Dis 2003; 41:E17.
- Suwata J, et al. New acetylcholinesterase inhibitor (donepezil) treatment for Alzheimer’s disease in a chronic dialysis patient. Nephron 2002; 91:330–332.
- Nagy CF, et al. Steady-state pharmacokinetics and safety of donepezil HCl in subjects with moderately impaired renal function. Br J Clin Pharmacol 2004; 58(Suppl 1):18–24.
- Tiseo PJ, et al. An evaluation of the pharmacokinetics of donepezil HCl in patients with moderately to severely impaired renal function. Br J Clin Pharmacol 1998; 46 (Suppl 1):56–60.
- Sahin OZ, et al. A rare case of acute renal failure secondary to rhabdomyolysis probably induced by donepezil. Case Rep Nephrol 2014; 2014:214359.
- Periclou A, et al. Pharmacokinetic study of memantine in healthy and renally impaired subjects. Clin Pharmacol Ther 2006; 79:134–143.
- Lefevre G, et al. Effects of renal impairment on steady-state plasma concentrations of Rivastigmine: a population pharmacokinetic analysis of capsule and patch formulations in patients with Alzheimer’s disease. Drugs Aging 2016; 33:725–736.
- AMAG Pharmaceutical Inc. Highlights of prescribing information. Vyleesi (bremelanotide injection) for subcutaneous use 2019; https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/210557s000lbl.pdf.
- Nelson ME, et al. Melanotan II injection resulting in systemic toxicity and rhabdomyolysis. Clin Toxicol (Phila) 2012; 50:1169–1173.
- Teva Pharmaceuticals USA Inc. Highlights of prescribing information. Austedo (deutetrabenazine) tablets for oral use 2020; https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/209885lbl.pdf.
- Lincoln Medical Limited. Wakix 4.5mg/18mg film-coated tablets 2016; https://www.medicines.org.uk/emc/product/7402.
- Bioprojet Pharma. Highlights of prescribing information. Wakix (pitolisant) tablets for oral use 2019; https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/211150s000lbl.pdf.
- Smith WB, et al. Effect of renal impairment on the pharmacokinetics of prucalopride: a single-dose open-label Phase I study. Drug Des Devel Ther 2012; 6:407–415.
- Shire Pharmaceuticals Limited. Resolor 1mg and 2mg film-coated tablets 2019; https://www.medicines.org.uk/emc/product/584/smpc.
- Sivabalasundaram V, et al. Prucalopride-associated acute tubular necrosis. World J Clin Cases 2014; 2:380–384.
- Jazz Pharmaceuticals UK. Sunosi 75mg and 140mg film-coated tablets 2020; https://www.medicines.org.uk/emc/product/11017/smpc.
- Zomorodi K, et al. Single-dose pharmacokinetics and safety of solriamfetol in participants with normal or impaired renal function and with end-stage renal disease requiring hemodialysis. J Clin Pharmacol 2019; 59:1120–1129.
- Neurocrine Biosciences Inc. Highlights of prescribing information. Ingrezza (valbenazine) capsules for oral use 2020; https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/209241lbl.pdf.
- Gregg LP, et al. Pharmacologic and psychological interventions for depression treatment in patients with kidney disease. Curr Opin Nephrol Hypertens 2020; 29:457–464.


