オピオイド依存症
オピオイド依存症に対する処方
注意:オピオイド依存症の治療は通常,専門医による介入を必要とする。専門医としての経験がない一般の医師は,オピオイド依存症の治療を試みる前に物質依存症治療施設に必ず連絡すべきである。一般精神科医は,依存症治療施設から助言を受けることなくオピオイド補充療法を開始しないよう強く推奨する。すべてのオピオイドに呼吸抑制作用がある。メサドンやブプレノルフィン等の処方オピオイドはオピオイド使用歴がない場合の致死量が低いため,忍容性の評価が難しい。
オピオイドの毒性により死に至ることがある。オピオイド離脱症状により死亡に至ることはない。
とはいえ,オピオイド離脱症状に耐えられず医学的助言に反して患者自ら退院した場合には危険も伴うため,適切な助言が得られるまでは非オピオイド系製剤を使用してオピオイド離脱症状の治療を行う必要がある(入院に関する項を参照)。
英国でオピオイド依存症患者の治療に使用されている介入には,持ち帰り用ナロキソン(THN)支給等の被害低減策(harm minimisation)から,メサドンやブプレノルフィン等のオピオイド補充療法(OST)による維持療法,naltrexoneによる再発予防まで様々なものがある。薬物療法は,心理社会的療法とともに,回復志向のケアにおいて不可欠である。本Chapterでは心理社会的療法については検討しない。依存症治療の心理社会的側面についてより詳しく理解するには,‘Routes to recovery’および‘Drug misuse and dependence: UK guidelines on clinical management’(一般的に「Orange Guideline」と呼ばれる)の心理社会的療法のChapterを参照されたい1, 2。
オピオイド過量投与の治療
オピオイド使用者における,オピオイド過量投与による死亡は防ぐことができる。ここでいうオピオイド過量投与には,ヘロインや最近ではフェンタニルやオキシコドンといった違法オピオイド系薬物と,メサドンやブプレノルフィン等の処方オピオイドの両方の過量投与が含まれる。
オピオイド過量投与の特徴は以下のとおりである。
- 意識消失
- 呼吸数(RR)低下(RR<12)
- 著しい縮瞳
- チアノーゼ
- 冷感・冷や汗
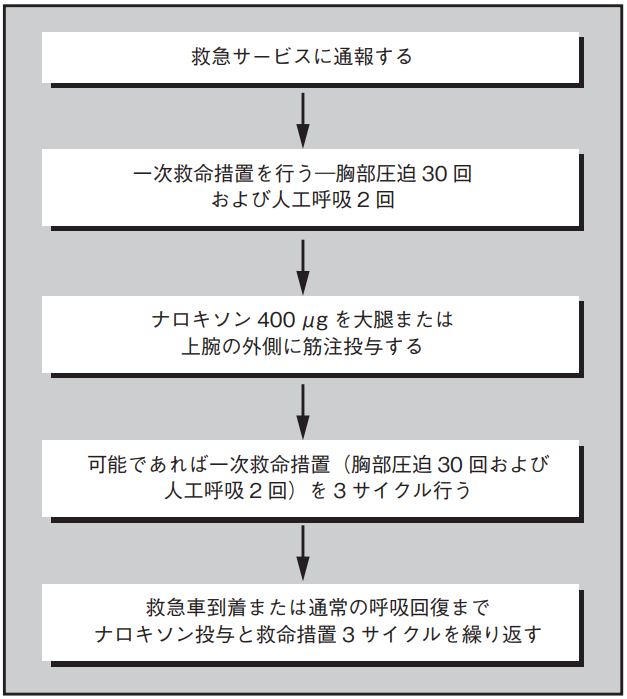
ナロキソンはオピオイド受容体拮抗薬であり,オピオイド過量投与をリバースさせることができる。ナロキソンは薬剤充填済みシリンジとして入手でき,救急車を呼び胸部圧迫を1サイクル行った後に筋注投与する。推奨される初期用量は400μgで,救急車到着あるいは呼吸回復まで,1サイクル30回の胸部圧迫を3サイクル行った後反復して投与することができる3 。ブプレノルフィンやフェンタニル等の親和性が高いオピオイドを置き換える場合は,高用量のナロキソンが必要となる場合がある4 。
オピオイドの有害な使用が疑われる患者やオピオイド依存症患者には,ナロキソン400μgの筋注/静注投与を「頓用」として処方すべきであり,病棟の蘇生用バッグに必ず入れておくべきである。過量服用死を防ぐためのナロキソン投与は,誰でも行うことができる。入院病棟から退院する患者には耐性が失われていることについて警告し,患者とその家族にはナロキソン投与のトレーニングとTHNを提供すべきである1 。オピオイドの過量服用に対する対処法を図 4.2 にまとめる。THN投与のトレーニングにはこの対処法を含めること。
図4.2 ナロキソン投与のフローチャート(出典:WHO3)
ナロキソン点鼻薬
最近,ナロキソンの濃縮点鼻薬(IN)がナロキソン筋注剤の代替として開発された5 。非医療従事者や偶然居合わせた人にとって注射による投与は,不安や手技に関する知識不足と,注射針による損傷のリスクがあるため困難かもしれないことから,ナロキソン注射剤の代替がTHNとして開発された6 。
ナロキソン1mg,2mgおよび4mg INの最高血漿中濃度(Cmax)は,ナロキソン400μg筋注剤の Cmax を超えるが 7 ,最高血中濃度到達時間(Tmax)は筋注投与時よりも長い(15-30分 vs 10分)。作用発現までの時間を考慮すると,2mg INが400μg筋注と等価となる。IN投与の方が筋注および静注投与と比べてナロキソンの血漿中濃度が長く維持される7 。
オピオイド補充療法(OST)
オピオイド依存症に対する薬理学的管理の中心はオピオイド補充療法(OST)である。OSTは解毒のために処方することができ,離脱症状をコントロールする用量を投与した後,漸減して中止する。あるいはOSTを「維持療法」として実施し,数ヵ月間から数年間にわたって長期間安定用量を投与する場合もある。
OSTは以下を目的として行う。
- 離脱症状を低減または予防すること
- 非処方箋薬の使用量を低減するか使用を止めさせること
- 薬物摂取量および生活様式を安定させること
- 薬物に関連する被害(特に注射行動)を低減すること
- 患者との連携を約束し,その機会を提供すること
治療は次の点に基づいて決定する。
- どの薬物療法が使用可能か,またその他の介入は使用可能か
- 患者の薬物使用歴および治療歴
- 患者の現時点での薬物使用状況および環境
- 治療を開始する場所/支援
精神的健康問題を抱える患者に対するOSTは,多くの場合,依存症治療専門施設で開始すべきであるが,精神科での適切な治療は継続すべきである8 。オピオイド依存症と精神的健康問題が併存する患者の一部は精神科病棟に入院し,一般精神科医がケアを引き継いだり早急に処方を開始したりしなければならない場合もある1 (後の項で詳述する)。
臨床医はOST処方の前に,患者が生理学的にオピオイドに依存していることを,オピオイド離脱の臨床的エビデンス,尿の薬物スクリーニング検査陽性,OST継続の記録等により十分確認する。
評価には以下を含める。
- 患者が摂取しているオピオイドの種類
- アルコールやその他の中枢神経抑制薬を含め,他に使用している薬物
- 使用しているすべての物質の頻度,量および投与経路
- 最後に使用した日時
- COPD等,処方決定に影響するかもしれない併存疾患
- OSTとの相互作用の可能性がある処方薬-呼吸抑制作用やQT延長作用のある薬剤
- これまでの治療経験
- 過量服薬歴
- 持ち帰り用ナロキソンを所持しているかどうか
- Objective Opiate Withdrawal Scale(OOWS),Clinical Opiate Withdrawal Scale(COWS)等,検証済みの評価尺度を用いてオピオイド離脱症状の客観的徴候があるかどうか(表4.8 参照)
- 注射部位の診察
- 通常のOST用量および最後の調剤用量についての依存症治療施設や薬局からの付随的情報
未治療のヘロインの離脱症状は,通常は最後に使用してから4-6時間後に始まり,32-72時間後にピークに達する。5日後には症状がかなり軽減するであろう。未治療のメサドン離脱症状は,通常は最後に使用してから4-6日後にピークに達し,症状は10-12日間軽減しない。未治療のブプレノルフィンの離脱症状は,通常は最長10日間持続する。特にオピオイド離脱の評価尺度として,COWS9 ,OOWS10 等が利用でき,依存および離脱レベルの評価に役立つ。
表4.8 Clinical Opiate Withdrawal Scale(COWS)
| 安静時脈拍:______回/分 1 分間座るか横になった後で測定: 0-脈拍80以下 1-脈拍81-100 2-脈拍101-120 4-脈拍120超 |
消化器機能異常 -評価前の30分間: 0-消化管症状なし 1-胃けいれん 2-悪心または軟便 3-嘔吐または下痢 5-下痢または嘔吐を繰り返す |
| 発汗 - 評価前の30分間,室温や患者の行動による発汗 は除く: 0-悪寒,潮紅ともに訴えなし 1-悪寒または潮紅の主観的報告 2-顔が火照っている,または汗ばんでいるのが見てわかる 3-額または顔に玉のような汗 4-顔から汗が流れ落ちている |
振戦 - 指を広げた状態を観察: 0-振戦なし 1-震えを感じるが見た目ではわからない 2-かすかな震えが見てわかる 4-大きな震えまたは筋けいれん |
| 不穏 - 評価中に観察: 0-じっと座っていることができる 1-じっと座っていることが苦しいと訴えるが,何とか 座っていられる 3-足/腕をしきりに,または理由もなく動かす 5-数秒間でもじっと座っていられない |
あくび - 評価中に観察: 0-あくびなし 1-評価中に1または2回のあくび 2-評価中に3回以上のあくび 4-1分間に複数回のあくび |
| 瞳孔の大きさ: 0-小さい,または室内光での正常な大きさ 1-室内光での正常な大きさより大きいと思われる 2-中程度に散大している 5-虹彩の縁のみが見える程度まで散大している |
不安または易刺激性(いらいら感): 0-なし 1-いらいら感や不安が増していると訴える 2-いらいら感または不安があるのが明らかである 4-評価に支障をきたすほどのいらいら感または不安がある |
| 骨や関節の疼痛 - 患者に以前から疼痛がある場合,オピオイド離脱によって増強した疼痛のみ評価する: 0-なし 1-軽度の不快感が広範にある 2-関節/筋肉に重度の広範な痛みがあると訴える 4-関節や筋肉をさすっている,または不快感のためじっと座っていられない |
鳥肌: 0-皮膚が滑らか 3-腕に鳥肌が立っているのが触れてわかる,または立毛している 5-顕著に鳥肌が立っている |
| 鼻汁または流涙 - 風邪の症状やアレルギーによるものは除く: 0-なし 1-鼻づまり,または通常よりも潤んだ目 2-鼻水または涙が出る 4-鼻水が常にたれている,または涙が頬を流れている |
総スコア___________ (全11項目の合計を総スコアとする) |
スコア:5-12=軽度,13-24=中等度,25-36=やや重度,37以上=重度の離脱症状
OSTの安全な処方
- ヘロイン依存症の治療薬として承認されている薬物(メサドンおよびブプレノルフィン)を使用する。
- 患者がオピオイド依存症であることを確認する。
- 安全な初回用量(以降を参照)を投与し,慎重に用量を調節する。
- 治療開始後数ヵ月間または状態が安定するまでは,摂取状況を連日監視する(状態安定=違法オピオイドを断っている)。
- 治療開始後数ヵ月間または状態が安定するまでは,持ち帰り用薬剤の処方は最低限にする。
維持OSTの処方の導入と安定化
維持OSTには,メサドンおよびブプレノルフィンの処方がNICEで推奨されている。メサドンおよびブプレノルフィン維持療法はいずれも,離脱症状の治療と違法オピオイド使用の低減に有効である11。最近のガイドラインやシステマティック・レビューでは,いずれかが優れているというエビデンスはないことが示されている1 。メサドンとブプレノルフィンの薬理作用は異なっている。メサドンはμオピオイド受容体の完全作動薬であるが,ブプレノルフィンは部分作動薬である。この薬理学的差異により,それぞれの薬剤には表 4.9 に示すような長所と短所がみられる。どちらを使用するかは,患者の希望,多剤使用の経験(特にベンゾジアゼピン系薬剤依存症またはアルコール依存症の併発),流用のリスク(薬剤を処方された患者本人がその薬剤を服用せず他人に売る/譲渡する),長期計画の内容(解毒レジメンにはどちらを使用したいか等),また,ブプレノルフィンの場合には,オピオイド離脱症状の誘発を回避するのに十分な期間ヘロイン使用を断つことができるかといった基準に基づいて,個別に判断する。少なくとも低用量では,ブプレノルフィンよりもメサドンを用いた方が治療を継続しやすいようである7 。
表4.9 補充療法におけるブプレノルフィンとメサドンの選択時に考慮する事項
| メサドン | ブプレノルフィン | |
| 離脱症候群 | 離脱症候群がより顕著かつ長期間である傾向─維持療法に使用するのが最良である | 離脱症候群がメサドンより軽度とみられるため,解毒プログラムに好んで使用される場合がある14, 15 |
| 開始時の差 | 用量調節期には死亡率が増加する 数週間かけて用量を徐々に調節し,治療域(60-100mg/日)に到達する必要がある |
用量調節時に死亡率は増加しない 数日間で治療域(12-16mg 1日1回)に到達できる まだ離脱症状がない場合に離脱症状が誘発されるリスクがある |
| 治療継続の差 | メサドンでは低用量のブプレノルフィン(<7mg)よりも治療が継続される | ブプレノルフィンでは可変で低用量(<7mg)の場合にのみ治療脱落者が増加する11 |
| 副作用の差 | メサドンはQTc延長およびトルサード・ド・ポアンを誘発する可能性があり,QT延長作用のある抗精神病薬を処方されている患者やコカインを併用している患者では特に懸念される | ブプレノルフィンはメサドンよりも鎮静作用が低いと認識されることが多く,この点は患者にとって望ましくない場合がある1 |
| 慢性疼痛 | オピオイド系鎮痛薬を併用する必要がある慢性疼痛患者では,「遮断」作用のあるブプレノルフィンの投与は難しい場合があるが,実際には大きな問題とはならないようである | 60mg 未満のメサドンより「遮断」作用が強いようである16-18。ブプレノルフィンを投与している患者に急性疼痛の治療が必要になった場合は,オピオイドを追加し,反応に応じて用量を調節して投与してもよい19 |
| 他剤との併用 | メサドンとCYP3A4阻害/誘導作用のある薬剤(エリスロマイシン,一部のSSRI,リバビリン,一部の抗けいれん薬,抗HIV薬等)との併用により,メサドンの血漿中濃度が変化する可能性がある。このようなCYP3A4阻害作用のある薬剤の使用状態が一定しない患者では,用量の評価が難しいことがある | ブプレノルフィンは薬物相互作用の影響を受けにくいので,一部の患者では使用が望ましいかもしれない |
| 妊娠 | 妊娠中に広く使用されている | ブプレノルフィンでは新生児薬物離脱症状の重症度がより軽度である20。しかし,胎児の離脱症状誘発リスクのために,ブプレノルフィン投与を妊娠中に開始あるいはメサドンからブプレノルフィンへの切り替えを行うべきではない |
| 娯楽目的での流用 | 薬剤の娯楽目的での流用のリスクが高い患者(例:流用歴がある患者,刑務所収監中の治療患者)に適していることがある | ブプレノルフィンの舌下錠は,錠剤が注射に使用されるリスクがあり,娯楽目的に流用されやすい 注射の欲求を低下させることがあるブプレノルフィン・ナロキソン合剤(Suboxone)が利用可能 |
| 管理 | 摂取状況の連日監視ができない場合は,ブプレノルフィンの使用が望ましいかもしれない1 |
患者の身体的な健康も考慮すべき重要な因子である。例えば,健康なオピオイド使用患者では,メサドンよりもブプレノルフィンの方が呼吸抑制を引き起こしにくいことを裏付けるエビデンスがいくつかある12。依存症治療施設を受診している患者の約1/3は,COPDに一致する肺気量測定値を示す13。しかし,この集団でブプレノルフィンの方が忍容性に優れていることを示す既報のエビデンスはない。
稀ではあるが,メサドンまたはブプレノルフィン,あるいはいずれかの製剤成分の一部に対してアレルギーのある患者もいる。
メサドン
臨床効果
メサドンは長時間作用型のオピオイド作動薬である。ヘロイン依存症の治療に有効な維持療法であり,患者に治療を継続させ,非オピオイド系薬ベースの補充療法よりもヘロインの使用を軽減させることが示されている11。また,患者が治療を継続して治療期間中のヘロインおよびコカインの違法使用を軽減させるうえで,高用量のメサドン(60-100mg)の方が低用量より有効であることが示されており,英国保健省(DoH)ガイドラインで推奨されている。ごく最近の小規模非盲検試験では,処方オピオイド依存症患者の処方オピオイド乱用を軽減し,患者に治療を継続させるうえで,メサドンの有効性はブプレノルフィンと同等であることが示されている21。また,メサドンはHIV伝播に関連する薬物使用行動の減少にも関連している。米国では,2017年のPOATS試験(n=653)で,ブプレノルフィンとナロキソンの合剤は,漸減療法ではなく維持療法(すなわち継続投与)として処方した場合,処方オピオイド依存症の治療に有効であることが明らかにされた22。
処方に関する情報:メサドンおよびブプレノルフィンは依存性の高い規制医薬品である。特にメサドンは致死量が低い。そのため,処方箋には患者の氏名,生年月日,住所,処方された1日量および総量を数字と文字の両方で記載する特別な要件が設けられている。監視下で使用する等の指示についても,例えば「摂取状況の連日監視」のように具体的に記載する。
メサドンを新たに処方する場合には,摂取状況の連日監視を数ヵ月間以上継続することが推奨される1 。それが不可能な場合には,分割処方により1日分ずつの交付および回収を行う。例外的な状況を除き,1回につき1週間分以上を処方すべきでない1 。COVID-19パンデミック期間に英国公衆衛生庁は,摂取状況を直接監視する際の社会的接触のリスクが,流用および過量服薬のリスクを上回るため,ほとんどの場合,交付する分量を緩和すると決定した。実際にこの変更がどのような結果をもたらしているのか,また,この変更が継続されるのか,従来の交付方法に戻るのかは現時点で不明である。
メサドンは,1mLあたり1mgを含有する経口液剤としてのみ処方する1 。処方箋には患者の住所および生年月日とともに,処方された1日量および総量を数字と文字の両方で記載する。監視についての指示は明確に記載する。錠剤は粉砕されて注射されるおそれがあるため,通常は処方すべきでない1, 23。
重要事項:メサドン投与プログラムを開始するすべての患者に対し,毒性および過量服薬のリスクがあること,また自宅に持ち帰った薬剤すべてを安全に保管する必要があることを知らせなければならない1, 24-26。小児のメサドン服用による悲劇的な死亡事故の発生例があるため,小児が同居している場合はとりわけ安全な保管が不可欠である。処方者が薬物使用者の評価および治療計画の作成を行う場合には,小児へのリスクを必ず考慮すべきである。
ヘロインや他のオピオイドを使用しており,メサドンの処方を受けていなかった患者の開始用量を設定する場合は,オピオイド毒性の可能性を考慮すべきであり,次の点に留意する。
- オピオイドに対する耐性は多くの因子の影響を受け,個々の患者における毒性リスクに重大な影響を及ぼしうる27。耐性評価において特に重要なのは,患者が申告する現在の使用量と使用頻度,および投与経路であるが,過大申告される可能性があるため注意を要する。患者のメサドンに対する耐性は,オピオイド使用の中止後3-4日以内に大幅に低下するため,それより後の期間には注意が必要であり,開始用量から慎重に用量を調節し直す。
- 他の中枢神経抑制薬(アルコール,ベンゾジアゼピン系薬剤,プレガバリン等の精神科薬)の使用は毒性リスクを高める。
- 年齢-薬物関連の死亡リスクは,45歳を超えると2.9倍に上昇する28。
- 身体的健康問題の併存(例:ベースラインの酸素飽和度が低値となるCOPD)。
- メサドンは消失半減期が長く,3-10日間で蓄積毒性が発現する可能性がある29, 30。ゆえに中毒徴候を定期的に評価し,傾眠徴候をはじめとするオピオイド毒性の所見が現れた場合には,投与を中断する。
- 特に最初の数日間は,不適切な投与により致死性の過量投与に至るおそれがある24, 25, 31, 32。メサドン1日30mg以下の投与開始後に死亡例が発生している1 。
低用量で開始し,用量が不十分であることが判明した場合に定期的に増量する方法が安全である。オピオイドとメサドンの直接換算表は慎重にみる必要がある。なぜなら,街で手に入るヘロインの質が変化する等,その時々で複数の要因が換算値に影響を及ぼすためである。認められる離脱症状に応じて用量を調節する方がはるかに安全である。
耐性の程度にもよるが,ほとんどの場合,メサドン10-30mg/日の範囲で投与を開始する1, 33。耐性の程度が明らかでない場合は,10-20mg/日で開始することが推奨される。急性期病棟では身体疾患がある可能性があり,精神科病棟では種々の精神作用薬による治療を受けていることがあるので,通常は開始量を最大20mg/日にすることが推奨される。
注意:作用は投与後30分以内に発現し,血漿中濃度は約2-4時間後にピークに達する。
在宅でのメサドンの導入と安定化
この方法は,3日以上メサドンが処方されていない患者(OSTを受けていて,3日以上処方薬を受け取っていない患者を含む)に適用される。メサドン投与開始から2週間は,過量投与による死亡率がかなり高い1, 23, 34-36。この期間中には,適切な評価と用量調節,およびモニタリングを実施することが重要である。導入は通常,尿毒性検査で評価してオピオイド使用と離脱の明らかな所見を確認した後に,適切な技量を有する医師が依存症治療施設で行う。
- 1週目
外来患者には,処方者が評価できるように最高で週に3回来院してもらい,離脱症状に応じて用量を調節する。増量は1回の来院につき5-10mg以内とし,通常は1週目に開始用量より30mg以上高い用量を投与すべきでない33。血漿中濃度は,最終増量後約5日間で定常状態になることに注意する。適切な用量で患者の状態が安定した後は,メサドンは1日1回連日で処方すべきである。頓用で処方したり,用量を変えたりすべきではない。最初の数ヵ月間は服用状況を監視することが望ましい。 - 2週目以降
1週間経過した後は,メサドン5-10mgずつの増量を継続し,増量間隔は少なくとも1週間空けるべきである1 。1日60-120mgの治療量に達するのに数週間かかることもある1。通常は6週間以内に安定するが,それより長期間を要することもある。しかし,一部の患者ではより早急に安定させなければならない場合もあることを考慮することが重要である。このような場合は高水準の監視,観察とのバランスをとる必要があり,それによってより急速な増量が可能になる。治療量とは,過剰な鎮静を生じさせずに,オピオイド離脱症状を除去し,ヘロインの使用を完全に中止させる効果を有する用量である37。処方者は,メサドン用量の選択に影響を及ぼしうる因子,例えばコカインによりメサドン濃度が低下するためコカインの併用や,45歳を超える場合には低用量メサドンにより過量服用のリスクが上昇する可能性があることから年齢等について考慮すべきである28。
メサドンに関する注意事項
- 中毒
特にアルコールまたは他の中枢神経抑制薬(例:ベンゾジアゼピン系薬剤)による中毒徴候を示す患者にはメサドンを投与すべきではない27, 38。メサドンとアルコールやベンゾジアゼピン系薬剤およびプレガバリン等の他の呼吸抑制薬を併用すると,過量投与のリスクが上昇し,致死的な過量投与のリスクが顕著に上昇する39, 40。メサドンの処方を検討する際には,多物質乱用による過量投与のリスクが高くなるので,アルコールや違法および処方薬物の併用に留意すべきである25, 31, 38, 41。 - 重度の肝機能障害,腎機能障害
メサドンの代謝と排出に影響を及ぼしうるので,臨床所見に応じて用量または投与間隔を調節すべきである。血漿中半減期が延長するため,投与初期には評価の間隔を延長する必要があるだろう。
メサドンの過量投与
メサドンの過量投与では,「オピオイドの過量投与」の項に従ってナロキソンを投与すべきである。
メサドンとトルサード・ド・ポアン/QT間隔延長のリスク
メサドンの単剤投与またはQT延長作用のある他の薬剤との併用投与は,QT間隔延長の可能性を高める場合があり,トルサード・ド・ポアンや死亡に至ることがある42-44。
推奨されるECGモニタリング
2006年,英国医薬品医療製品規制庁(MHRA)は以下のようなQT間隔延長の危険因子を有する患者では,メサドン投与期間中は慎重にモニタリングすることを推奨している:心疾患または肝疾患,電解質異常,CYP3A4阻害作用があるかQT間隔延長をもたらす可能性がある薬剤(一部の抗精神病薬やエリスロマイシン等)の併用。コカインおよび「Spice」と呼ばれる合成カンナビノイド受容体作動薬(SCRA)もQT延長をもたらす可能性があるため,コカインやSpiceを併用する患者もモニタリングする必要がある45, 46。さらに,QTc延長は用量依存性であるため42,1日100mgを超えるメサドンを必要とする患者は綿密なモニタリングを行う47。QT延長のリスクを上昇させるその他の患者因子には,摂食障害の併存,心疾患または心臓発作の既往,肝疾患,低カリウム血症や低カルシウム血症等の代謝異常,HIV感染(薬物療法は問わない)等がある48。
したがって,上記の危険因子がある患者ではベースラインのECGを行い,その後もECGによるモニタリングを継続すべきである。最適なモニタリング間隔については厳密なエビデンスが得られていないが,心臓症状がない場合は年1回以上の頻度でECGを行うのが妥当と考えられる。また,メサドンと併用する薬剤はCYP3A4阻害作用について確認し,メサドン投与開始時にリスク・ベネフィット分析に関する情報を患者に提供することも重要である49。 ブプレノルフィンはQTc延長作用がメサドンより低いようであるため,この点に関してはメサドンより安全と考えられるものの50,この分野でこれまでに実施されている研究はわずかであり,適切なオピオイド補充療法を選択するうえで考慮しなければならない因子は他にも多くある。
講じるべき措置を表 4.10 に簡潔に示す。QT延長が疑われる場合には,必ず専門医の助言を得るようにする。ECGモニタリングに関するレビューでは,メサドン維持療法を行っている患者において,心疾患の罹病や死亡の予防に対するQTcスクリーニング戦略の有効性を示すエビデンスは不十分であり,状況によっては,ECGは患者がメサドン投与プログラムを開始または継続するのを妨げかねないとの懸念がある51。医療施設や精神科病棟へ入院してメサドンを使用している,もしくは開始する患者には必ずECGを行うべきである。在宅で治療を行う場合,高用量の投与を受けている患者や他の危険因子がある患者では,可能であればECGを行うべきであるが,外来患者がECGモニタリングを拒否する場合にはリスクとベネフィットを考慮すべきである。
表4.10 推奨されるECGモニタリング
| QTc延長(境界域) | 措置 | QTc延長 | 措置 | 高度のQTc延長 | 措置 | |
| 女性 | ≧470ms |
|
≧500ms |
|
≧550 ms |
|
| 男性 | ≧440 ms |
ブプレノルフィン
ブプレノルフィン(ほとんどの国でSubutexとして販売)は合成のオピオイド部分作動薬であり,内活性は低いが,μオピオイド受容体に対する親和性が高い。そのため受容体飽和用量であっても多幸感が小さく,他のオピオイドの作用を同時に阻害する。適正用量のメサドンの効果を上回ることはないが,固定用量での使用はヘロイン依存症の治療に有効である11。ブプレノルフィンはメサドンと比べて治療が継続される可能性が低いことに関連しており,また臨床経験から,ブプレノルフィンを開始するのに十分な,ただし治療施設の受診を妨げない程度の離脱症状にとどめるには,微妙なバランスを取る必要があるため,ブプレノルフィンの開始は難しい場合があることが示唆される。同時に,ブプレノルフィンは,処方オピオイドの依存症患者において,処方オピオイド使用量を減らし,治療に対するアドヒアランスを改善するうえで有効であることが明らかにされている21。解毒治療の完了という点ではブプレノルフィンとメサドンの間に有意な差は認められないが,ブプレノルフィンの方が離脱症状が速やかに消失する可能性がある52。
ブプレノルフィンの舌下投与
ブプレノルフィンで最もよく処方されるのは,舌下経路で吸収される剤形である。錠剤は約5-10分で崩壊し吸収される。次の性質により,オピオイド依存症の治療に有効である。
- オピオイド離脱症状および渇望を緩和もしくは予防する。
- 受容体への親和性が高く,患者がよく「妨害(blocking)」効果と呼ぶ作用があり,オピオイドを追加使用した場合の作用を減弱させる16-18。
- 作用持続時間が長く,1日1回(またはそれより低頻度)の投与でよい。作用持続時間は用量依存性を示し,低用量(例:2mg)投与時の作用持続時間は最長12時間である一方,高用量(例:16-32mg)では48-72時間もの長時間に及び,週3回の投与ですむ。
ブプレノルフィン徐放性注射剤
ブプレノルフィン徐放性皮下注用製剤(英国およびEUでの商品名は「Buvidal」,米国での商品名はSublocade等)が,週1回および月1回投与の注射剤として英国で承認されている(表4.11)。職業または学業に従事している患者,定期的に出張する必要のある(毎日薬剤を受け取ることが困難な)患者,連日投与レジメンを遵守することが難しい患者等,週1回または月1回投与のデポ剤の方が望ましい場合がある患者がいるかもしれず,また効果も得られるかもしれない。
ブプレノルフィン徐放性注射剤のもたらす効果はブプレノルフィン舌下錠と同様で,離脱症状および渇望の抑制のほか,オピオイドを追加使用した場合にオピオイド遮断作用をもたらす。持続放出性であり,ブプレノルフィン舌下錠のように顕著なピーク時やトラフ時を経験することが少ないという患者もいる。したがってオピオイドの「追加」使用が抑えられる可能性がある。ブプレノルフィン徐放性注射剤の禁忌は,有効成分または賦形剤に対する過敏症またはアレルギー,重度の肝機能障害,アルコール依存症および振戦せん妄である。
表4.11 従来のブプレノルフィン舌下錠の1日投与量とそれに相当する週1回および月1回投与用Buvidal® の推奨用量
| ブプレノルフィン舌下錠の1日投与量 | 週1回投与用Buvidal®の用量 | 月1回投与用Buvidal® の用量 |
| 2-6mg | 8mg | 32mg |
| 8-10mg | 16mg | 64mg |
| 12-16mg | 24mg | 96mg |
| 18-24mg | 32mg | 128mg |
ブプレノルフィンの別の経口製剤とバイオアベイラビリティ
Espranorはブプレノルフィン製剤の1つであり,英国では在宅での依存症治療で使用されることが増えている。Espranorは舌下ではなく舌の上に置く。ブプレノルフィンの薬物動態は極めて個人間変動が大きいことが示されているが53,PKの変動はある程度,個々の治療反応に応じて徐々に用量を調節することで許容される。ただし,ブプレノルフィンまたは他のブプレノルフィン製剤をEspranorに切り替える場合は,臨床経験に基づいて開発された以下の換算票を使用する。
| ブプレノルフィン舌下錠 | Espranor(口腔内崩壊錠) |
| 8mg | 6mg |
| 10mg | 8mg |
| 12mg | 10mg |
| 14/16mg | 12mg |
| 18mg | 14mg |
| 20/22mg | 16mg |
| >26mg | 18mg |
等価換算量が明確にされていないため,特に理由がなければ製剤間の切り替えはしないことが賢明である。
ブプレノルフィンの開始用量
投与開始時には,メサドンと同様の原則が適用される。薬物依存症治療施設以外の医師は,ブプレノルフィンが標準的な尿中薬物検査キットでは,メサドン,コデイン,ヘロインのようには検出されないことを認識する必要がある。ブプレノルフィンは一般に,依存症治療施設以外では通常入手できない別の尿中薬物スクリーニング(UDS)キットを使用して検査する。そのため,ブプレノルフィンの使用を適時に知るためには,使用状況について薬局に確認し,場合によっては尿サンプルの特別検査の依頼を検討すべきである。一方で,ブプレノルフィンに関して特に興味深い現象は,離脱症状の誘発がみられることである。離脱症状が誘発されるのは,ブプレノルフィンが受容体親和性の高い部分作動薬であるためである。メサドンやヘロインのような完全作動薬が残存する状態で脳内に移行すると,オピオイド受容体との結合において完全作動薬と競合的に置き換わる。そのため,完全な刺激作用を受けていた受容体の一部は部分的に刺激を受けることとなる。このような変化を,患者はオピオイド離脱症状として経験する。すでに離脱症状が認められる患者では,部分作動薬を追加することで限定的に受容体が刺激され,離脱症状が緩和される。初期離脱症状誘発の問題を抑制するうえで,患者の教育は重要な因子である。
ブプレノルフィンの初回投与は,離脱症状誘発のリスクを低減するために,患者がオピオイド離脱症状(作動活性が低下していることを示す徴候)を呈しているときに行う。メサドンと同様に,ブプレノルフィンの処方前に,患者が毎日オピオイドを使用していること(薬物検査等)および離脱症状があることの確認が必須である。
推奨される初回投与量を以下に示す。
| 離脱症状があり危険因子を有しない | ブプレノルフィン8mg |
| 離脱症状がなく危険因子を有しない | ブプレノルフィン4mg |
| 危険因子を伴う(例:身体状態,多剤乱用,依存症の重症度が低いか不確定,他の精神科薬を使用している) | ブプレノルフィン2-4mg |
専門医がいない場合,初日に8mgを超える量のブプレノルフィンを投与してはならない。一部の症例では8mgで十分かもしれないが,離脱症状が持続して中毒の所見がない場合には翌日12-16mgに増量してもよいだろう。中毒が生じたときに迅速な評価ができるように分割投与すべきであるものの,実際には往診して薬剤を交付しない限り難しい。維持療法の場合は,「Orange Guideline1 」で12-24mg/日の用量が推奨されている。16mgより高い用量が必要であると考えられる場合は専門医の指示が必要であり,依存症専門医の指示の下でのみ増量すべきである。
患者がベンゾジアゼピン系薬剤等の呼吸鎮静薬を使用している場合は低用量を使用すべきであり,中毒と呼吸抑制に対するモニタリングを行う。
メサドンからブプレノルフィンへの切り替え
切り替えは通常,十分な経験のある専門の処方者の監督下で行う。メサドンからの切り替え患者では離脱症状が誘発されるリスクがあり,軽度の離脱症状が1-2週間持続することがある。離脱症状誘発に影響を及ぼす因子を表4.12に示す。
表4.12 メサドンからブプレノルフィンへの切り替えに伴う離脱症状誘発リスクに影響を及ぼす因子
| 要因 | コメント | 推奨される方策 |
| メサドンの用量 | 30mgを超えるメサドンが投与されていた場合に誘発されやすい。一般に,メサドンの用量が高いほど誘発される離脱症状の重症度が高い54 | 40mg未満(30mg以下が望ましい)のメサドンからの切り替えを試みる。メサドンの用量が60mgを超える場合には,切り替えを試みるべきでない |
| メサドンの最終投与とブプレノルフィンの初回投与の間隔 | 24時間以上間隔をあける。間隔を長くとるほど,離脱症状の発現率および重症度が低下する55, 56 | メサドン投与を中止し,メサドンの離脱症状が発現するまで初回投与を遅らせる |
| ブプレノルフィンの用量 | 極めて低用量のブプレノルフィン(例:2mg)は,メサドンの代替としては一般に不十分である。ブプレノルフィンの初回用量が高いと(例:8mg),離脱症状が誘発されやすい | 初回用量は通常4mgとし,投与2-3時間後に患者を観察する |
| 患者の予期 | 離脱症状の誘発を予期していない患者は,誘発の影響により苦痛・混乱をきたす可能性が高まる | 事前に患者に情報提供する。重度の症状発現に備えて,緊急事態対応計画を用意する |
| 他の薬剤の使用 | 症状の緩和には,対症療法薬(例:lofexidine)が有用な場合がある | 管理計画に従って処方する |
用量40mg未満(理想的には30mg以下)のメサドンからブプレノルフィンへの切り替え
メサドン投与は突然中止し,最終投与から24時間以上経過してから,ブプレノルフィンの初回投与を行う。投与開始時に推奨される換算量を以下に示す。臨床所見によって,2回目以降に増量が必要な場合がありうる。
| メサドンの最終用量 | 1日目(初回)のブプレノルフィン用量 | 2日目のブプレノルフィン用量 |
| 20-40mg | 4mg | 6-8mg |
| 10-20mg | 4mg | 4-8mg |
| 1-10mg | 2mg | 2-4mg |
用量40-60mgのメサドンからブプレノルフィンへの切り替え
- メサドンは,不安定または混乱状態にならない範囲でできる限り減量し,その後,突然投与を中止する。
- 明らかな離脱徴候が現れるまで(一般にメサドンの最終投与の48-96時間後まで),ブプレノルフィンの初回投与は行わない。
- 初回用量は2-4mgとする。投与2-3時間後に患者を観察する。
- 離脱症状が誘発された場合には,対症療法薬を追加処方してもよい。
- 離脱症状の誘発または悪化がみられなかった場合には,同じ日にブプレノルフィン2-4mgを追加してもよい。
- 翌日も患者を観察し,8-12mgに増量する。
60mgを超える用量のメサドンからブプレノルフィンへの切り替え
このような切り替えは,熟練した医師が例外的状況で実施する場合を除き,外来で試みるべきではない。通常はメサドンを部分的に解毒し,メサドンの用量が1日30mg以下となった後にブプレノルフィンに切り替える。これより高用量のメサドンからブプレノルフィンへの切り替えが必要な場合には,可能であれば入院病棟への紹介を検討すべきである。
その他の処方オピオイドからブプレノルフィンへの切り替え
処方オピオイド依存症のブプレノルフィンによる治療についてはエビデンスが得られつつあり,薬物療法に対するアドヒアランスを改善し,処方オピオイド乱用を軽減することが認められている21。英国では「Orange Guideline」により,少量の分割投与によって安定化に必要な用量を確立することが推奨されている1 。
*注意:ブプレノルフィン投与直後に離脱症状が悪化した場合は,用量調節が必要と考えられる。
患者管理鎮痛法からのブプレノルフィン開始
患者管理鎮痛法(PCA)は,一般に重度の急性疼痛の管理に用いられている。患者は,あらかじめ定めた限度内で要望に応じてオピオイド(例:モルヒネ,フェンタニル)の静脈内投与を受けることができる57。
PCA施行前にブプレノルフィンを処方されていた患者では,PCAを受けている間に,オピオイド補充療法の開始用量としてブプレノルフィン0.4mgの1日4回舌下投与を処方することが推奨される。離脱症状誘発リスクを高める通常のピーク濃度を避けるため,ブプレノルフィンの時間差投与が重要である。
PCAが不要となった初日(表4.13 の1日目)に,ブプレノルフィン2mgの1日2回舌下投与に増量することができる。翌日に,4mgの1日2回投与に増量することができる。3日目までに,ブプレノルフィン8mgを1日1回投与することができる。ブプレノルフィン投与直後に離脱症状が悪化した場合は,用量調節が必要と考えられる。その場合はブプレノルフィンの投与を中断し,依存症治療専門施設に連絡して助言を受けること。
表4.13 患者管理鎮痛法からの再開*
| 日 | PCA 施行中 | 舌下ブプレノルフィンの用量 | 投与頻度 |
| 0 | はい | 0.4mg | 1日4回 |
| 1 | いいえ | 1mg | 1日2回 |
| 2 | いいえ | 2mg | 1日2回 |
| 3 | いいえ | 4mg | 1日1回 |
ブプレノルフィン用量の安定化
外来患者の場合,最初の数日間は定期的に来院してもらい,処方者による評価および用量の調節を行う。必要に応じて1日2-4mgずつ,1日量の上限を32mgとして増量する。推奨される有効維持用量は12-16mg/日であり1 ,一般的にはブプレノルフィンの投与開始後1-2週間以内と,通常はメサドンの場合よりも速やかに維持用量に到達できる。
ブプレノルフィンの服用頻度が1日1回未満の場合
英国では,ブプレノルフィンは連日投与される薬剤として承認されている。国際的なエビデンスおよび経験によれば,多くの患者は2-3日毎の投与で無理なく維持療法を受けることができる58-61。このような投与法が適正であると考えられるのは,娯楽目的での流用のリスクがあるため,ブプレノルフィンの持ち帰りが適切でないと判断される投与患者である。
推奨される換算量を次に示す。
| 2日毎に投与する場合のブプレノルフィンの用量=2×1日量(32mgを上限とする) |
| 3日毎に投与する場合のブプレノルフィンの用量=3×1日量(32mgを上限とする) |
注意:ブプレノルフィンでは無理なく安定化した状態が得られない患者(メサドンからの切り替え患者に多い)には,メサドンへの切り替えという選択肢を用意すべきである。メサドンは,ブプレノルフィン最終投与の24時間後に開始できる。ブプレノルフィンの「遮断」作用が数日間持続することがある,すなわちメサドンの毒性が遅れて現れる可能性があることに留意しつつ,臨床反応に応じて用量を調節する。
ブプレノルフィンに関する注意事項
- 肝機能:肝疾患の既往のある患者では,高用量のブプレノルフィンにより,肝機能の変化が引き起こされる可能性を示唆するエビデンスがある程度得られている62。このような患者では,ブプレノルフィンの投与開始前にLFTを実施し,6-12週間後に経過観察の測定を行う。重度の肝疾患患者等,特に懸念される患者では,これより高頻度の検査を検討すべきである。ただし,臨床的に重大な肝疾患がない患者における肝酵素活性の高値は,必ずしもブプレノルフィン投与の禁忌ではない。
- 中毒:ブプレノルフィンは,中毒,特にアルコールまたは他の中枢神経抑制薬(例:ベンゾジアゼピン系薬剤,鎮静作用のある抗精神病薬,プレガバリン39)による中毒徴候を呈する患者には投与しない。ブプレノルフィンを他の鎮静薬剤と併用すると,呼吸抑制,鎮静,昏睡,および死亡に至るおそれがある。ブプレノルフィンの処方を検討する際には,多物質乱用による過量投与のリスクが高くなるので,アルコールや違法薬物の併用を念頭に置くべきである。
ブプレノルフィンの過量投与
ブプレノルフィンは単剤では呼吸抑制を起こすことが少なく,過量服用による死亡が発生する可能性が低いため,一般にメサドンやヘロインよりも安全性が高いとされている63。しかし,呼吸抑制作用のある他の薬剤を併用している場合は,その影響を管理することは難しくなるだろう。ブプレノルフィンの効果をリバースするために非常に高用量のナロキソン(例:10-15mg)が必要となることがあり(ただし,0.8-2mg等の低用量でも十分なこともある)4 ,ブプレノルフィンが呼吸抑制に寄与している症例(多剤過量投与例等)ではしばしば換気補助が必要になる。
ブプレノルフィン/ナロキソン(Suboxone)
娯楽目的での流用のリスクを低減させる可能性のあるブプレノルフィン/ナロキソン製剤(Suboxone)の使用を処方者は考慮してもよい。ブプレノルフィンとナロキソンは舌下と非経口の吸収プロファイルの違いが重要な因子であり,舌下投与したときのナロキソンの作用は極めて小さい。しかし,合剤を注射するとナロキソンが大きな作用をもたらして,短期的にブプレノルフィンの作用を減弱させるため,オピオイド完全作動薬を使用しているオピオイド依存症患者に離脱症状を誘発する可能性が高い64。
その他の経口オピオイド製剤
治療の主流は,依然としてメサドンおよびブプレノルフィンの経口製剤である1 。英国では,徐放型モルヒネ経口薬(SROM),ジヒドロコデイン等のその他の経口製剤はオピオイド依存症の治療薬として承認されていない1 。
ごく例外的な状況(例:患者がメサドンまたはブプレノルフィン投与に耐えられない場合)では,専門臨床医がジヒドロコデイン経口製剤を維持療法として処方してもよいが,その場合には,ジヒドロコデインの消失半減期が短いことに関連する問題,監視の必要性,および娯楽目的で流用される可能性を勘案する1 。
欧州の他の国では,メサドン投与に耐えられない患者の維持療法としてSROMの有用性が示されているが,ジヒドロコデインと同様,専門臨床医による処方に限定すべきである1 。 SROMに関する研究のレビューでは,この治療法の効果を評価するにはエビデンスが十分得られていないことが示唆されている65。
維持療法のためのdiamorphine注射剤の処方
第一選択のOSTで効果が認められなかった患者の維持療法において,diamorphine注射剤の処方を支持する説得力のあるエビデンスが得られている66。現在の注射剤処方は,以前の監視なしのオピオイド注射剤処方とは,患者に以下を求める点で異なっている。
- 維持療法のオピオイド注射剤処方には,治療計画に従って連日あるいはより頻繁に,患者本人が来院する。
- 適格なスタッフによる直接の監視下で注射剤を投与する。
- 持ち帰り用の注射剤は交付しない。
英国では,オピオイド依存症に対してdiamorphineを処方する医師には,英国内務省による認可が必要である。注射剤を1日1回投与するクリニックが利用できず監視下で投与を受けられない場合は,OST経口薬を何日分か処方する。この治療法は,(通常治療中ではない患者を対象に)静注薬を投与するための,滅菌機器を備えた安全な「注射室」のみで行う治療とは異なり,補助的な心理社会的介入と併用される全人的ケア・パッケージの一環として行う。費用対効果が明らかにされているものの67,設置費用が高いため実施は限られている。
現時点では,患者へのオピオイド注射剤の処方は,幅広いケア・パッケージの一環として,心理社会的介入と併用される場合に限り検討すべきである。患者が経口オピオイドによる補充療法に十分反応せず,なおかつ薬物摂取の監視に必要な体制が整っており,それによるサポートが可能な地域であれば,選択肢となる1, 68。 患者は通常,専門施設に行き,監視下で1日2回の注射を受ける。急性期病院に入院してdiamorphineを処方された患者を治療する医師は,地域で定められた方針を確認する必要がある。処方を継続するには,通常,当該地域の処方した依存症専門精神科医と書面で連絡を取り合えば十分である。
精神科病棟でのオピオイド依存症治療
オピオイド過量投与は病院で起こる場合がある。オピオイド依存症の既往があるすべての入院患者には,「頓用」としてナロキソンを処方すべきである。
入院環境下では,患者が病棟に留まって,精神科入院の原因に合わせた治療介入を受けられるように,オピオイド離脱症状の管理が不可避である。精神科への緊急入院時にオピオイド離脱症状を予防する最も有効な方法は,本人が使用しているOSTの継続である。同じ用量のOSTを継続して処方するため,以下を個別に確認する必要がある。
- 依存症治療施設に処方用量を確認する。
- OSTを交付した薬局に,監視下での最後の投与と持ち帰り用薬剤交付の有無を確認する。監視下での最後の投与から3日以上経過している場合は,過量投与を避けるためOSTを開始し直す必要がある(次の「投与の開始」に関する項を参照)。週末に入院した患者は持ち帰り用薬剤を交付されている場合があり,直接質問されない限り,必ずしもそのことを言い出さない可能性がある。OSTの最後の投与から3日以上経過している場合は耐性が失われており,依存症治療医の助言に従って開始し直す必要がある。
報告された用量でのOSTの処方継続は,上記の情報を確認したうえで,以下の場合にのみ行うべきである。
- この用量で患者は覚醒し快適な様子である。
- 患者に他の物質の中毒の様子はない。
経験の浅い医師は,上記の情報を確認したうえでOSTを安全に処方することが直ちにできない環境でも,オピオイド離脱症状を呈する患者の管理ができていると考えてしまう可能性がある。致死的ではないものの,オピオイド離脱には高度の嫌悪症状があり,入院治療が必要な患者が自ら退院した場合には危険を伴う。援助を求められるようになるまでは他の薬剤がオピオイド離脱症状の管理に有用となる場合がある。ただし,一度OSTが処方されると,OST導入期間は多剤併用や多物質使用に伴うリスクがあり,他の薬剤は使用しないことが推奨されるため,その余地はほとんどない。英国では現在,薬物依存症治療の臨床ガイドラインで個別の症状に対する治療法が推奨されている(表4.14)1 。
救急で精神科に入院した患者はOSTを解毒すべきではなく,またオピオイド依存症の患者がまだ治療を受けていない場合にはOSTの開始を検討すべきである(地域の依存症専門医の助言に従うこと)。
表4.14 個別の症状に照準を合わせた薬物依存の治療
(出典:Drug misuse and dependence: UK guidelines on clinical management 20171)
| 症状 | 治療 |
| 下痢 | ロペラミド4mgを投与後,軟便のたびに2mgを投与する。16mg/日までとし最長5日間 |
| 悪心,嘔吐 | メトクロプラミド10mg1日3回を最長5日間,あるいはプロクロルペラジン5mgを1日3回または12.5mg筋注を1日2回 |
| 胃けいれん | mebeverine 135mgを1日3回 |
| 激越,不安,不眠 | ジアゼパムを必要に応じて最大5-10mg1日3回,またはベンゾジアゼピン依存症の既往がある患者に対してゾピクロン7.5mg就寝前 |
| 筋肉痛,頭痛 | paracetamol(アセトアミノフェン),アスピリン,または非ステロイド性抗炎症薬。メサドン離脱による筋肉痛の緩和には外用の発赤薬が有用な場合がある |
急性期病棟での(または依存症治療施設以外の専門外の医師による)メサドン投与の開始
導入-1日目
COWS(表4.8 参照)等のオピオイド離脱症状尺度による評価で,客観的なオピオイド離脱症状があることを確認する。
- 離脱症状の重症度に応じて,メサドン1mg/1mL混合剤で10mgを投与する。これは1回のみの投与とすべきである。メサドンは投与後20-30分後に作用し始め,4時間後にピークに達する。
- 4時間毎に離脱症状の徴候のモニタリングを継続し,必要に応じて5-10mgを追加で投与する。中毒徴候も観察する。
- 最初の1日の用量(24時間)は通常,30mgを超えないようにする。
- 過量投与の場合には「必要に応じて」ナロキソンを処方する。初期用量が少量でも反復投与により徐々に毒性が現れるため,蓄積に注意する。
2日目
- 1日目に患者が必要とした用量を単回または分割して投与する。
- 離脱症状と鎮静のモニタリングを継続する。
継続処方
- 離脱症状が完全に消失するまで,依存症治療の専門医に相談して3-4日毎に5-10mgずつの増量を検討する。
- 状態が安定したら必要量の処方を継続する。
急性の入院患者では,通常は解毒を試みるより安定用量を維持する方がよい。
1日2回から1日1回の投与への切り替え
急性期病院から精神科に移行する際,患者はメサドンの分割投与を受けていることが多い。在宅治療での分割投与は流用のリスクを伴うため,妊娠している場合を除き推奨されない。退院前日に,1日1回の投与に切り替え,メサドンのピーク濃度で発現する傾向のある鎮静および呼吸抑制をモニタリングすべきである。
オピオイド依存症に対する向精神薬の処方
一般精神科医は併存する精神疾患を治療することを視野に入れて依存症患者の診察を行うことが多い。併存精神疾患に対する薬物療法については,英国精神薬理学会による物質乱用の管理に関するガイドラインに一般的指針が提示されている69。併存精神疾患に対して承認されている鎮静作用のある薬剤は,例えばプレガバリンの過量服用による死亡等,呼吸抑制のリスクが上昇するため,通常は慎重に処方すべきである39。また,プレガバリンやオランザピンはオピオイド依存症患者における乱用傾向があるようである70, 71。オピオイド依存症患者はうつ病罹患率が高く,治療を開始する患者の約半数がうつ病の基準を満たす。うつ病に罹患している患者では罹患していない患者と比較して,安定化のために20-50%高い用量のメサドンが必要となる場合があるが72,大部分の症例で安定化により寛解が得られるかもしれない73。オピオイド依存症患者における抗うつ薬の使用については,臨床試験によって質が低-中程度の限られたエビデンスが得られているが,気分と薬物使用いずれについても有用性は限定的であることが示唆されている69, 73。肯定的な結果が得られた研究の大部分では,三環系抗うつ薬(TCA)等,種々の薬理学的作用を持つ薬剤が使用されているが74,TCAは心毒性があるため併存疾患のある物質乱用者には推奨されない75。うつ病治療では,最初にOSTで患者を安定化させ,抑うつが持続する場合にはまず比較的安全性の高いSSRIの投与を試みるが,反応が得られない場合には第二選択として種々の薬理学的作用を持つ薬剤の使用を検討するアプローチがエビデンスに基づき推奨される74。メサドンの投与を受けている患者では,相互作用の可能性が低いためセルトラリンが選択される。
オピオイドの解毒および減量レジメン
オピオイド維持療法の継続期間は,臨床上の必要性に応じて数週間からほぼ無期限まで様々である。オピオイド用量を短期間で安定化させた後に解毒することを希望する患者もいれば,維持療法の処方により長期間かけて用量を安定化させた後に解毒することを希望するかもしれない患者もいる。すべての解毒プログラムは,ケア・プログラムの一環として実施すべきである。解毒後の過量投与は重篤で致命的な結果を招く危険があるため,解毒治療を行う施設はこれらのリスクについて患者を教育するとともに,ナロキソンを提供し,過量投与時の緊急投与の訓練を行うべきである。
解毒期間の長さについて,NICEガイドラインには「用量の減量は数日間-数ヵ月間かけて行うが,安定化時の初期用量が高い場合にはこれより長い期間をかけて漸減させる」と記載されており,「メサドンの減量期間は一般に最長3ヵ月間である一方,ブプレノルフィンの減量期間は14日間-数週間である」と示されている76。実際には,在宅で解毒を行うことにより解毒プロセスにおける患者の快適度が高まり,ケア計画を遵守でき,また解毒期間中および解毒後に違法薬物使用を断ち続けることができる場合には,より長時間をかけて在宅で解毒を行ってもよい。
入院により解毒を行う場合,NICEガイドラインは「院内のサポート環境が離脱症状に耐える助けになるため」在宅より短い期間(メサドンで14-21日間,ブプレノルフィンで7-14日間と推奨)で解毒できる可能性があるとしている77。在宅で解毒する場合は,オピオイド補充療法の用量を安定化させた後に用量を漸減し,離脱症状に対して必要に応じて慎重に追加の薬物療法を処方する。
解毒には再発リスクと致死的となりうる過量投与のリスクがあることが認識されている。したがって,患者に解毒を行う場合はリハビリテーションプログラムや地域での支援等,適切なアフターケアが必要になる。救急で精神科または一般内科に入院した患者は,専門機関による支援およびアフターケアが揃っていない限り解毒の適応とならない。
在宅でのオピオイド離脱治療
メサドン
メサドン用量の安定化期間またはより長期間の維持療法後,ケア計画の一環としてメサドンの1日量を減らす減量プログラムについて,患者と処方者の間で合意するのがよい。一般的な減量スケジュールは1週間または2週間毎に5-10mgずつであるが,減量幅および減量速度は様々である。在宅での治療の場合,減量幅および減量速度に関しては患者の希望が最も重要な因子である。解毒プログラムは定期的に見直し,違法薬物の再使用,減量速度に関する患者の不安といった変化に柔軟に対応すべきである。ヘロインまたは他の薬物の使用量増加,患者の身体的,心理的,または社会的健全性の悪化といった要因により,一時的な増量または維持,あるいは減量速度の緩徐化が必要になる場合がある。解毒の終了に近づいてきたら,減量速度を遅くして週に1-2mgずつにしてもよい。最近の研究では,維持療法の安定化期間を長くとり,減量スケジュールを延長(最長1年)すれば,断薬を達成する確率が大幅に改善することが示されている78。
ブプレノルフィン
ブプレノルフィンの解毒レジメンを計画する場合は,メサドンと同じ原則を適用する。離脱中の不快感を最小限にとどめるため,用量は徐々に減らすべきである。推奨される減量レジメンを以下に示す。
| ブプレノルフィンの1日量 | 減量速度 |
| 16mg超 | 1-2週間毎に4mgずつ |
| 8-16mg | 1-2週間毎に2-4mgずつ |
| 2-8mg | 1または2週間毎に2mgずつ |
| 2mg未満 | 週に0.4-0.8mgずつ |
依存症治療施設入院によるオピオイド離脱治療
メサドン
メサドンの開始用量は,専門の入院治療チームが48時間にわたり評価する。その後,最長4週間かけて直線的に用量を減らしてもよい76。
ブプレノルフィン
ブプレノルフィンは短期入院による解毒において,メサドンと同様の原則に従って有効に使用できる。
naltrexoneによる再発防止
オピオイド乱用者における再発予防の治療としてのnaltrexoneの有用性に関するエビデンスは決定的ではない79。しかし,患者が断薬プログラムを希望し,治療により生じうる副作用と便益について十分な情報を知らされており,なおかつ治療継続の意欲が高く,また患者を支えるパートナーがいる場合は,naltrexoneがオピオイド乱用からの断薬の補助として費用対効果が高いことがNICEにより確認されている80。英国では未承認であるが,naltrexoneの埋込み製剤も治療意欲の高い患者集団においてオピオイド使用量の減少に有効である可能性がある81。
naltrexoneの投与開始時には過量投与による死亡リスクが高まるため,綿密なモニタリングが特に重要である。naltrexoneの投与中止時にも,違法オピオイドの不注意による過量投与が起こりやすい可能性がある。したがって,naltrexone投与の監視と,処方を受ける患者の慎重な選択(断薬に集中でき,断薬意欲が高い患者)が極めて重要である。naltrexoneの使用者にはしばしば不安(不快気分),抑うつ,不眠といった副作用が発現し,naltrexone投与期間中に違法オピオイド使用を再開したり,投与を継続できなかったりすることがある。不快気分は,違法薬物からの離脱またはnaltrexone投与自体により引き起こされることがあるため,心理社会的療法および一般的なサポートを含むケア・プログラムの一環としてnaltrexoneを処方することが重要である80。
naltrexone投与の開始
naltrexoneは,オピオイドを現在使用中の患者,あるいはオピオイドの使用歴があり,なおかつnaltrexone使用前に十分な「休薬」期間を設けていない患者で重度の離脱反応を引き起こす傾向がある。
オピオイド使用中止からnaltrexone投与開始までの推奨される最短期間は,使用していたオピオイドの種類,使用期間,最終使用量によって異なる。メサドン等の消失半減期の長いオピオイド作動薬は,最長10日間の休薬期間を必要とする一方,ヘロイン,モルヒネ,フェンタニル等の短時間作用型オピオイドの休薬期間は最長7日間のみでよいかもしれない。ブプレノルフィンの使用経験からは,最終用量が2mg超,使用期間が2週間を超える場合,休薬期間は7日間で十分であることが示唆されている。状況によっては(例:ブプレノルフィンの最終用量が2mg未満,使用期間が2週間未満の場合),中止後2-3日以内にnaltrexone投与を開始できるかもしれない。
naltrexoneの投与を開始する前に,(naltrexoneより消失半減期が大幅に短い)ナロキソン(0.2-0.8mg)の筋肉内投与を試験的に行ってもよい。離脱症状が誘発されたとしても,naltrexoneによるものより持続時間が短い。
投与開始前に,離脱症状のリスクがあることを患者に助言しなければならない。オピオイドを含有する薬剤(例:市販鎮痛薬)を気付かずに使用したことがないかどうか,患者から十分に聴取することは有益である。
naltrexone処方に関する重要点
- naltrexone投与中にはオピオイド過量投与による死亡リスクが高まることを患者に十分かつ確実に伝える。
- 解毒および断薬期間の後はオピオイドに対する耐性が著しく低下する。そのような時期にオピオイドを使用すると,過量投与のリスクが大幅に高まる。
- naltrexoneの投与中止により違法オピオイドの不注意による過量投与のリスクが高まることもあるため,投与中止時には綿密なモニタリングおよびサポートが必要である。
naltrexoneの用量
適切なオピオイド休薬期間(および必要に応じてナロキソンの試験投与)の後,naltrexone 25mgの投与を開始する。初回投与後はオピオイドの離脱症状の有無を4時間にわたってモニタリングする。投与初日には,離脱症状に対する対症療法薬(例:lofexidine)を必要に応じて使用できるようにしておく(離脱症状が持続しうる時間は最長で4-8時間)。患者がこの低用量のnaltrexoneに耐えることができた場合には,その後は維持用量として1日50mgまで増量してもよい。
naltrexoneは肝機能障害患者では禁忌であり,治療期間中はLFTによるモニタリングを行う。
OSTを受けている患者の疼痛管理
メサドン処方下の患者における鎮痛
適切な場合には,非オピオイド系鎮痛薬[例:paracetamol(アセトアミノフェン), NSAIDs]をまず優先的に使用する。疼痛の種類および重症度によりオピオイド系鎮痛薬(例:コデイン,ジヒドロコデイン,モルヒネ)の適応がある場合には,通常の鎮痛プロトコルに沿って鎮痛が得られる用量に調節する。
メサドン処方患者でオピオイド系鎮痛薬が適切な場合には,メサドン以外のオピオイドを併用処方してもよい。すなわち,患者が必要とするすべてのオピオイドを1種類の薬剤に「整理」する必要はない82。ある種の状況では鎮痛効果が得られる用量までメサドンを漸増してもよいが,熟練した専門医による実施に限るべきである。
本Chapterの他の箇所で概説したように,ブプレノルフィンや naltrexone の使用患者では,鎮痛目的で処方されたオピオイドが比較的効きにくいと予想されるが,臨床では,ブプレノルフィン使用患者で急性疼痛の治療を必要とする場合には,患者の反応をみながらオピオイドを追加してもよい19。オピオイド系鎮痛薬を処方するためにnaltrexoneを中止する場合には,再発および過量投与のリスクが共に高まるため,綿密なモニタリングが必要である35, 82。
また,物質依存歴のある患者が,手術,外傷または他の疾患により病院での急性疼痛管理を必要とする場合がある。急性疼痛期における主な目標は,疼痛管理と離脱症状の回避である。これらの目標を達成するためには,双方に対する十分な基礎治療薬投与の持続が重要である。入院中の疼痛管理を担当するチームおよび地域の物質依存治療施設との連携とともに,患者との協調的な話し合いが重要である。物質依存治療施設が患者を知っている場合,施設は治療計画に関する情報を提供し,街で手に入る薬物(これらの薬物を摂取している患者の場合)から処方鎮痛薬への確実な切り替えの支援や,急性疼痛の治療から物質依存の管理継続への円滑な移行の計画支援を行うことができる35。詳細については,British Pain Society(英国疼痛学会),Royal College of Psychiatrists(英国王立精神科医学会),Royal College of General Practitoners(英国王立家庭医学会),および Advisory Council on the Misuse of Drugs(薬物乱用諮問委員会)のコンセンサス声明を参照のこと82。
コンセンサス声明で勧告されているように,緩和ケアにおける鎮痛治療の原則には「物質依存者と緩和ケアを必要とするその他の成人患者の間に本質的な違いはない」が,物質依存治療施設との緊密な連絡が必須である。オピオイド依存症の患者が物質依存治療施設で維持療法を受けている場合があるが,慢性の非癌性疼痛について前述されている通り,「これは外来(ペインクリニック)受診時の鎮痛治療とは別の処方とみなすべきである」。入院期間中,すべての薬物療法は一般に入院病棟で行うが,「疾患末期の場合を除き,退院時に物質依存と症状緩和を別々に追跡するための明確な計画を立てる」82。詳細については,コンセンサス声明を参照のこと82。この声明の公表以降,慢性疼痛に使用される非オピオイド系薬であるプレガバリンの乱用の可能性や70,過量投与の危険性を上昇させるプレガバリンとオピオイドの処方の可能性が懸念されている39。慢性疼痛に対するプレガバリンの処方には注意が必要である。
妊娠とオピオイド使用(本Chapterの「妊娠中の物質乱用」の項も参照)
オピオイド依存症は妊娠のいずれのステージでも認められる可能性があり,メサドン補充療法による安定化が第一選択の治療法である。妊娠第1三半期の解毒は自然流産のリスクを伴うため禁忌であり,妊娠第3三半期の解毒は早産,胎児ジストレス,死産との関連が認められている。妊婦が解毒を希望した場合,最も安全に施行できるのは妊娠第2三半期であるが,不安定状態の徴候を慎重にモニタリングしつつ,適切な技量のある専門医が監視する。解毒では少量ずつ頻繁に減量する(例:3-5日毎にメサドンを2-3mgずつ1 )。強制による解毒は,一部の患者が支援を求めることを止めてしまう可能性が高いため禁忌である。そのような患者の大部分は妊娠期間中にオピオイドを再び使用するようになり83,違法オピオイドの間欠的使用により母体の血中オピオイドが変動すると,胎児に離脱症状または過量投与が生じるおそれがある84, 85。ブプレノルフィンでは新生児薬物離脱症状の重症度がより軽度である14。しかし,胎児の離脱症状誘発リスクがあるため,ブプレノルフィン投与を妊娠中に開始したり,メサドンからブプレノルフィンに切り替えたりすべきではない。
妊娠期間における補充療法の処方
集学的チーム(産科チーム,麻酔科医,新生児科医,依存症専門医を含む)による,全人的ケア・パッケージとすべきである。妊娠期間における補充療法についてのエビデンスは少ない86。現在のところ,メサドンとブプレノルフィンの安全性に差は認められないようである。メサドンの方が治療継続率が高く,ブプレノルフィンの方が新生児薬物離脱症候群(NAS)の重症度が低い86。そのため最新のガイドラインでは,患者がいずれかを選ぶ,あるいは妊娠時に使用していた方を継続することが提言されている1 。妊娠中はSuboxoneの使用を避けるべきである。ただし,胎児離脱症状のリスクがあるため,メサドンからブプレノルフィンへの切り替えは推奨されない。妊娠第3三半期にはメサドン代謝能が高まる可能性があり,分割投与が必要となる。
新生児薬物離脱症候群(NAS)
母親がメサドン維持療法を受けている場合は,大部分の新生児にNASの治療が必要となる83。NASは,自律神経系,消化器(GI)系,呼吸器系に関連した様々な徴候や症状を特徴とする84。乳児には甲高い号泣,空腹な様子だが効果的ではない哺乳行動,過度の覚醒が認められる場合がある。重度のNASは緊張亢進やけいれん発作を伴うが,稀である。メサドン治療によるNASは通常生後48時間で発症するが87,7-10日後に発症する場合もある1 。妊娠中に薬物を使用している,またはOSTを受けている場合には,新生児のモニタリングおよび必要に応じた治療を行うため,高度な新生児医療を利用できることが重要である。母乳栄養によりNASの重症度が軽減される可能性がある(以下参照)。
オピオイドが処方されている妊婦の場合は,オピオイド鎮痛に伴う問題を予想しておくことが有用である。このような女性は関連リスクが高いため,妊産婦専門の医療機関が管理すべきである。予想される麻酔のリスク,鎮痛の必要性および静脈アクセスに伴う問題については,麻酔科医による出産前評価が推奨されうる。
授乳
メサドンやブプレノルフィンを処方されている女性には,違法オピオイドの使用を継続している場合であっても1,以下の理由から授乳を奨励すべきである。
- 母親および乳児の全般的な健康のため
- NASという観点では,入院期間を短縮させ,介入の必要性を低下させるため88
- メサドンやブプレノルフィンの乳児への移行は低濃度であるため88
授乳を突然中止するとNASが遅れて発症する可能性があるため,徐々に中止するよう患者に警告する必要がある88。クラック・コカインまたは高用量のベンゾジアゼピン系薬剤を摂取している患者は授乳すべきではない1 。
(櫻井 準)
参照文献
- Department of Health and Social Care. Drug misuse and dependence: UK guidelines on clinical management. 2017; https://www.gov.uk/government/publications/drug-misuse-and-dependence-uk-guidelines-on-clinical-management.
- Ellis K, et al. Routes to recovery. 2007; http://americanradioworks.publicradio.org/features/nola/transcript.html.
- World Health Organization. Community management of opioid overdose. 2014; http://www.who.int/substance_abuse/publications/management_opioid_overdose/en.
- FDA. FDA advisory committee on the most appropriate dose or doses of naloxone to reverse the effects of life-threateningopioid overdose in the community settings. 2016; https://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/AnestheticAndAnalgesicDrugProductsAdvisoryCommittee/UCM522688.pdf.
- Strang J, et al. Naloxone without the needle – systematic review of candidate routes for non-injectable naloxone for opioid overdose reversal. Drug Alcohol Depend 2016; 163:16–23.
- Beletsky L, et al. Prevention of fatal opioid overdose. JAMA 2012; 308:1863–1864.
- McDonald R, et al. Pharmacokinetics of concentrated naloxone nasal spray for opioid overdose reversal: phase I healthy volunteer study. Addiction 2018; 113:484–493.
- National Institute for Health and Care Excellence. Coexisting severe mental illness and substance misuse: community health and social care services. NICE Guidance NG58. 2016; https://www.nice.org.uk/guidance/ng58.
- Wesson DR, et al. The Clinical Opiate Withdrawal Scale (COWS). J Psychoactive Drugs 2003; 35:253–259.
- Handelsman L, et al. Two new rating scales for opiate withdrawal. Am J Drug Alcohol Abuse 1987; 13:293–308.
- Mattick RP, et al. Buprenorphine maintenance versus placebo or methadone maintenance for opioid dependence. Cochrane Database Syst Rev 2014; 2:CD002207.
- Comer SD, et al. Abuse liability of prescription opioids compared to heroin in morphine-maintained heroin abusers. Neuropsychopharmacology 2008; 33:1179–1191.
- Jolley CJ, et al. P214 The prevalence of respiratory symptoms and lung disease in a South London ‘lung health in addictions’ service.Thorax 2016; 71:A201.
- Seifert J, et al. Detoxification of opiate addicts with multiple drug abuse: a comparison of buprenorphine vs. methadone. Pharmacopsychiatry 2002; 35:159–164.
- Jasinski DR, et al. Human pharmacology and abuse potential of the analgesic buprenorphine: a potential agent for treating narcotic addiction. Arch Gen Psychiatry 1978; 35:501–516.
- Bickel WK, et al. Buprenorphine: dose-related blockade of opioid challenge effects in opioid dependent humans. J Pharmacol Exp Ther 1988; 247:47–53.
- Walsh SL, et al. Acute administration of buprenorphine in humans: partial agonist and blockade effects. J Pharmacol Exp Ther 1995; 274:361–372.
- Comer SD, et al. Buprenorphine sublingual tablets: effects on IV heroin self-administration by humans. Psychopharmacology 2001; 154:28–37.
- Alford DP, et al. Acute pain management for patients receiving maintenance methadone or buprenorphine therapy. Ann Intern Med 2006; 144:127–134.
- Jones HE, et al. Neonatal abstinence syndrome after methadone or buprenorphine exposure. N Engl J Med 2010; 363:2320–2331.
- Nielsen S, et al. Opioid agonist treatment for pharmaceutical opioid dependent people. Cochrane Database Syst Rev 2016; Cd011117.
- Weiss RD, et al. The prescription opioid addiction treatment study: what have we learned. Drug Alcohol Depend 2017; 173 Suppl 1:S48–S54.
- Department of Health Task Force to Review Services for Drug Misusers. Report of an independent review of drug treatment services in England. 1996; http://www.dh.gov.uk.
- Caplehorn JR. Deaths in the first two weeks of maintenance treatment in NSW in 1994: identifying cases of iatrogenic methadone toxicity. Drug Alcohol Rev 1998; 17:9–17.
- Zador D, et al. Deaths in methadone maintenance treatment in New South Wales, Australia 1990–1995. Addiction 2000; 95:77–84
- Hall W. Reducing the toll of opioid overdose deaths in Australia. Drug Alcohol Rev 1999; 18:213–220.
- White JM, et al. Mechanisms of fatal opioid overdose. Addiction 1999; 94:961–972.
- Gao L, et al. Risk-factors for methadone-specific deaths in Scotland’s methadone-prescription clients between 2009 and 2013. Drug Alcohol Depend 2016; 167:214–223.
- Wolff K, et al. The pharmacokinetics of methadone in healthy subjects and opiate users. Br J Clin Pharmacol 1997; 44:325–334.
- Rostami-Hodjegan A, et al. Population pharmacokinetics of methadone in opiate users: characterization of time-dependent changes. Br J Clin Pharmacol 1999; 48:43–52.
- Harding-Pink D. Methadone: one person’s maintenance dose is another’s poison. Lancet 1993; 341:665–666.
- Drummer OH, et al. Methadone toxicity causing death in ten subjects starting on a methadone maintenance program. Am J Forensic Med Pathol 1992; 13:346–350.
- National Institute for Clinical Excellence. Methadone and buprenorphine for the management of opioid dependence. Technology Appraisal guidance [TA114]. 2007 (last checked February 2016). https://www.nice.org.uk/guidance/ta114.
- Amato L, et al. Methadone at tapered doses for the management of opioid withdrawal. Cochrane Database Syst Rev 2013; 2:CD003409.
- Cornish R, et al. Risk of death during and after opiate substitution treatment in primary care: prospective observational study in UK General Practice Research Database. BMJ 2010; 341:c5475.
- Strang J, et al. Loss of tolerance and overdose mortality after inpatient opiate detoxification: follow up study. BMJ 2003; 326:959–960.
- Bell J. Pharmacological maintenance treatments of opiate addiction. Br J Clin Pharmacol 2014; 77:253–263.
- Farrell M, et al. Suicide and overdose among opiate addicts. Addiction 1996; 91:321–323.
- Abrahamsson T, et al. Benzodiazepine, z-drug and pregabalin prescriptions and mortality among patients in opioid maintenance treatment-A nation-wide register-based open cohort study. Drug Alcohol Depend 2017; 174:58–64.
- Pierce M, et al. Impact of treatment for opioid dependence on fatal drug-related poisoning: a national cohort study in England. Addiction 2016; 111:298–308.
- Neale J. Methadone, methadone treatment and non-fatal overdose. Drug Alcohol Depend 2000; 58:117–124.
- Krantz MJ, et al. Torsade de pointes associated with very-high-dose methadone. Ann Intern Med 2002; 137:501–504.
- Kornick CA, et al. QTc interval prolongation associated with intravenous methadone. Pain 2003; 105:499–506.
- Martell BA, et al. The impact of methadone induction on cardiac conduction in opiate users. Ann Intern Med 2003; 139:154–155.
- Mayet S, et al. Methadone maintenance, QTc and torsade de pointes: who needs an electrocardiogram and what is the prevalence of QTc prolongation? Drug Alcohol Rev 2011; 30:388–396.
- Hancox JC, et al. Synthetic cannabinoids and potential cardiac arrhythmia risk: an important message for drug users. Ther Adv Drug Saf 2020; 11:2042098620913416.
- Medicines and Healthcare Products Regulatory Agency. Risk of QT interval prolongation with methadone. Curr Prob Pharmacovigilance 2006; 31:6.
- Isbister GK, et al. Drug induced QT prolongation: the measurement and assessment of the QT interval in clinical practice. Br J Clin Pharmacol 2013; 76:48–57.
- Cruciani RA. Methadone: to ECG or not to ECG … that is still the question. J Pain Symptom Manage 2008; 36:545–552.
- Wedam EF, et al. QT-interval effects of methadone, levomethadyl, and buprenorphine in a randomized trial. Arch Intern Med 2007; 167:2469–2475.
- Pani PP, et al. QTc interval screening for cardiac risk in methadone treatment of opioid dependence. Cochrane Database Syst Rev 2013; 6:CD008939.
- Gowing L, et al. Buprenorphine for managing opioid withdrawal. Cochrane Database Syst Rev 2017; 2:Cd002025.
- Strain EC, et al. Relative bioavailability of different buprenorphine formulations under chronic dosing conditions. Drug Alcohol Depend 2004; 74:37–43.
- Walsh SL, et al. Effects of buprenorphine and methadone in methadone-maintained subjects. Psychopharmacology 1995; 119:268–276.
- Strain EC, et al. Acute effects of buprenorphine, hydromorphone and naloxone in methadone-maintained volunteers. J Pharmacol Exp Ther 1992; 261:985–993.
- Strain EC, et al. Buprenorphine effects in methadone-maintained volunteers: effects at two hours after methadone. J Pharmacol Exp Ther 1995; 272:628–638.
- Grass JA. Patient-controlled analgesia. Anesth Analg 2005; 101:S44–S61.
- Amass L, et al. Alternate-day buprenorphine dosing is preferred to daily dosing by opioid-dependent humans. Psychopharmacology 1998; 136:217–225.
- Amass L, et al. Alternate-day dosing during buprenorphine treatment of opioid dependence. Life Sci 1994; 54:1215–1228.
- Johnson RE, et al. Buprenorphine treatment of opioid dependence: clinical trial of daily versus alternate-day dosing. Drug Alcohol Depend 1995; 40:27–35.
- Eissenberg T, et al. Controlled opioid withdrawal evaluation during 72 h dose omission in buprenorphine-maintained patients. Drug Alcohol Depend 1997; 45:81–91.
- Berson A, et al. Hepatitis after intravenous buprenorphine misuse in heroin addicts. J Hepatol 2001; 34:346–350.
- Paone D, et al. Buprenorphine infrequently found in fatal overdose in New York City. Drug Alcohol Depend 2015; 155:298–301.
- Stoller KB, et al. Effects of buprenorphine/naloxone in opioid-dependent humans. Psychopharmacology 2001; 154:230–242.
- Ferri M, et al. Slow-release oral morphine as maintenance therapy for opioid dependence. Cochrane Database Syst Rev 2013; 6:CD009879.
- Strang J, et al. Heroin on trial: systematic review and meta-analysis of randomised trials of diamorphine-prescribing as treatment for refractory heroin addiction dagger. Br J Psychiatry 2015; 207:5–14.
- Byford S, et al. Cost-effectiveness of injectable opioid treatment v. oral methadone for chronic heroin addiction. Br J Psychiatry 2013; 203:341–349.
- Strang J, et al. Supervised injectable heroin or injectable methadone versus optimised oral methadone as treatment for chronic heroin addicts in England after persistent failure in orthodox treatment (RIOTT): a randomised trial. Lancet 2010; 375:1885–1895.
- Lingford-Hughes AR, et al. Evidence-based guidelines for the pharmacological management of substance abuse, harmful use, addiction and comorbidity: recommendations from BAP. J Psychopharmacol 2012; 26:899–952.
- Baird CR, et al. Gabapentinoid abuse in order to potentiate the effect of methadone: a survey among substance misusers. Eur Addict Res 2014; 20:115–118.
- James PD, et al. Non-medical use of olanzapine by people on methadone treatment. B J Psych Bull 2016; 40:314–317.
- Tenore PL. Psychotherapeutic benefits of opioid agonist therapy. J Addict Dis 2008; 27:49–65.
- Nunes EV, et al. Treatment of depression in patients with alcohol or other drug dependence: a meta-analysis. JAMA 2004; 291:1887–1896.
- Nunes EV, et al. Treatment of co-occurring depression and substance dependence: using meta-analysis to guide clinical recommendations. Psychiatr Ann 2008; 38:nihpa128505.
- Lingford-Hughes AR, et al. BAP updated guidelines: evidence-based guidelines for the pharmacological management of substance abuse, harmful use, addiction and comorbidity: recommendations from BAP. J Psychopharmacol 2012; 26:899–952.
- National Institute for Clinical Excellence. Drug misuse in over 16s: opioid detoxification. Clinical Guidance 52. 2007; https://www.nice.org.uk/guidance/cg52.
- National Institute for Clinical Excellence. Drug misuse in over 16s: psychosocial interventions. Clinical Guidance [CG51]. 2007; (last checked July 2016). https://www.nice.org.uk/guidance/cg51.
- Nosyk B, et al. Defining dosing pattern characteristics of successful tapers following methadone maintenance treatment: results from a population-based retrospective cohort study. Addiction 2012; 107:1621–1629.
- Minozzi S, et al. Oral naltrexone maintenance treatment for opioid dependence. Cochrane Database Syst Rev 2011; 4:CD001333.
- National Institute for Clinical Excellence. Naltrexone for the management of opioid dependence. Technology Appraisal [TA115]. 2007 (reviewed November 2010); https://www.nice.org.uk/guidance/ta115.
- Kunoe N, et al. Naltrexone implants after in-patient treatment for opioid dependence: randomised controlled trial. Br J Psychiatry 2009; 194:541–546.
- The British Pain Society, et al. Pain and substance misuse: improving the patient experience. A consensus statement prepared by The British Pain Society in collaboration with The Royal College of Psychiatrists, The Royal College of General Practitioners and The Advisory Council on the Misuse of Drugs. 2007; http://www.britishpainsociety.org/book_drug_misuse_main.pdf.
- Winklbaur B, et al. Treating pregnant women dependent on opioids is not the same as treating pregnancy and opioid dependence: a knowledge synthesis for better treatment for women and neonates. Addiction 2008; 103:1429–1440.
- Finnegan LP. Neonatal abstinence syndrome. in RA Hoekelman, et al., ed. Primary pediatric care. St Louis: Mosby 1992; 1367–1378.
- Winklbaur B, et al. Opioid dependence and pregnancy. Curr Opin Psychiatry 2008; 21:255–259.
- Minozzi S, et al. Maintenance agonist treatments for opiate-dependent pregnant women. Cochrane Database Syst Rev 2013; 12:CD006318.
- Fischer G, et al. Methadone versus buprenorphine in pregnant addicts: a double-blind, double-dummy comparison study. Addiction 2006; 101:275–281.
- Holmes AP, et al. Breastfeeding considerations for mothers of infants with neonatal abstinence syndrome. Pharmacotherapy 2017; 37:861–869.

