認知症
認知症は進行性の症候群で,65歳以上の約5%に発症し,80代以上になるとその割合は20%に上昇する。この疾患の特徴は,認知機能低下,記憶や思考の障害,日常生活を営むのに必要な能力が徐々に失われることにある。気分や人格および社会的行動がしばしば変化する1。
認知症は,脳を冒す病態プロセスの違いによっていくつかのタイプに分類される。最も多いのはアルツハイマー病(AD)で,全認知症の約60%を占める。その他の症例は,大半が血管性認知症とレビー小体型認知症(DLB)である。ADと血管性認知症は併存することもあり,臨床的には区別が困難なことが多い。また,パーキンソン病患者の約30-70%にも認知症が認められる1 (パーキンソン病の項を参照 のこと)。
アルツハイマー病
アルツハイマー病に用いられる認知機能改善薬の作用機序
アセチルコリンエステラーゼ(AChE)阻害薬
ADのコリン仮説は,脳内のコリン作動性ニューロンの進行性減少とアセチルコリン(ACh)濃度の低下が認知機能低下と相関する,という観察に基づく2 。しかし,現在ではコリン作動性の枯渇がADにみられる症状の単独の原因であるとの見方はされていない3 。
英国その他では現在,軽度から中等度のAD型認知症の治療薬として,ドネペジル,リバスチグミン,ガランタミンという3剤のAChE阻害薬(AChE-I)が承認されている。この3剤は現在,重度ADの治療にも推奨されている。さらに,リバスチグミンはパーキンソン病に伴う軽度から中等度の認知症に対する治療薬としても承認されている。
アセチルコリンエステラーゼ(AChE)およびブチリルコリンエステラーゼ(BuChE)はいずれもAChの分解において重要な役割を担うことが明らかにされている4 。AChE-Iは薬理作用がそれぞれ異なる。ドネペジルはAChEを選択的に阻害し,リバスチグミンはAChEとBuChEの両方に作用し,ガランタミンはAChEを選択的に阻害してニコチン受容体作動薬としても作用する5 。これまでのところ,こうした薬理作用の違いによる有効性や忍容性の重要な差は示されていない(AChE-Iの比較は,表 6.1 を参照のこと)。
メマンチン
英国その他では,メマンチンは,中等度から重度のAD型認知症の治療薬として承認されている。メマンチンは,N-メチル-D-アスパラギン酸(NMDA)受容体に低-中等度の親和性を有する非競合的NMDA受容体拮抗薬で,NMDA受容体に優先的に結合して受容体作動性カルシウムチャネルを開口させることで治療効果を発揮すると考えられている。この活動依存的な結合によりNMDAを介したイオン流入を遮断し,神経機能障害を引き起こすとされるグルタミン酸濃度の持続的な異常上昇(とその興奮毒性)を軽減すると考えられている6(表 6.1 を参照のこと)。
表6.1 認知機能改善薬の特徴7-14
| 薬剤 | ドネペジル | リバスチグミン | ガランタミン | メマンチン |
| 主な作用機序 | AChE-I (選択的+可逆的) |
AChE-I (可逆的非競合的阻害薬) |
AChE-I (競合的+可逆的) |
グルタミン酸受容体拮抗薬 |
| その他の作用機序 | なし | BuChE-I | ニコチン受容体作動薬 | 5-HT3受容体拮抗薬 |
| 開始量 | 5mg/日 | 1.5mgを1日2回(経口) (または貼付剤4.6mg/24時間 |
徐放性製剤8mg/日 (または内服液4mgを1日2回) (速放性錠剤は一部の国で販売中止) |
5mg/日 |
| 通常治療量 (および最大量) |
10mg/日 | 3-6mgを1日2回(経口) または貼付剤9.5mg/24時間 |
徐放性製剤16-24mg/日 (または内服液8-12mgを1日2回) |
20mg/日 (または10mgを1日2回) |
| 推奨される増量の最小間隔 | 4週間 (5mg/日ずつ増量) |
経口薬の場合は2週間 (1.5mgを1日2回ずつ増量) 貼付剤の場合は4週間 (9.5mg/24時間に増量) (9.5mg/24時間で忍容性があり,かつ重大な認知的または機能的低下があった場合には,6ヵ月後に13.3mg/24時間に増量を検討してもよい) |
4週間 (徐放性製剤8mg/日ずつまたは内服液4mgを1日2回で増量) |
1 週間 (5mg/週ずつ増量) |
| 副作用7-13 * 非常によくみられる副作用:≧1/10および よくみられる副作用:≧1/100 |
下痢*,悪心*,頭痛*,感冒,食欲不振,幻覚,激越,攻撃的行動,異常な夢および悪夢,失神,浮動性めまい,不眠症,嘔吐,胃腸障害,発疹,掻痒症,筋けいれん,尿失禁,疲労,疼痛 | 食欲不振*,浮動性めまい*,悪心*,嘔吐*,下痢*,食欲減退,悪夢,激越,錯乱,不安,頭痛,傾眠,振戦,腹痛および消化不良,発汗,疲労および無力症,倦怠感,体重減少(貼付剤による副作用の発現頻度はカプセル剤とは異なる可能性がある) | 悪心*,嘔吐*,食欲減退,幻覚,抑うつ,失神,浮動性めまい,振戦,頭痛,傾眠,嗜眠,徐脈,高血圧,腹痛および腹部不快感,下痢,消化不良,筋けい縮,疲労,無力症,倦怠感,体重減少,転倒 | 薬物過敏症,傾眠,浮動性めまい,平衡障害,高血圧,呼吸困難,便秘,肝機能検査値上昇,頭痛 |
| 半減期(時間) | 約70 | 約1(経口) 3.4(貼付剤) |
7-8(内服液) 8-10(徐放カプセル) |
60-100 |
| 代謝 | CYP3A4 CYP2D6(わずか) |
CYPアイソザイムの関与はごくわずか | CYP3A4 CYP2D6 |
ほとんど肝代謝を受けない |
| 薬物相互作用 | あり(別表を参照) | 相互作用はないと思われる | あり(別表を参照) | あり(別表を参照) |
| 食事による吸収への影響 | なし | 吸収速度,吸収量が遅延する | 吸収速度が遅延するが吸収量には影響なし | なし |
| 英国での薬剤費7, 14 (通常量=最大量を1ヵ月使用した場合) |
錠剤:£1.52 口腔内崩壊錠:£10.43 内服液(1mg/mL):£100.22 |
カプセル:£66.10 内服液(2mg/mL):£135.55 貼付剤 9.5mg:£19.97 4.6mgおよび 13.3mg:£77.97 |
カプセル放出調節製剤:£79.80 内 服 薬(4mg/mL: £201.60 |
錠剤:£8.46 口腔内崩壊錠:£49.98 内服薬(10mg/mL):£61.77 注:ボトルには1回につき5mg/0.5mLが出る投薬ポンプが付いている |
| 相対費用 | $ | $$ | $$ | $ |
| 特許 | ジェネリックが市販されている | ジェネリックが市販されている | ジェネリックが市販されている | ジェネリックが市販されている |
認知症に用いられる認知機能改善薬の有効性
現在のところ,認知症の進行を修正したり逆転させたりする治療法は存在しない。そのため,治療介入は特定の症状を標的とするか,認知機能低下の改善や遅延を目的として行われる。AChE-Iにより,軽度から中等度のADに対する認知面,機能面,全般的な有益性を得られる可能性がある15。
ミニメンタルステート検査(MMSE)およびアルツハイマー病評価尺度-認知機能検査(ADAS-cog)で評価した結果より,AChE-I 3剤の臨床効果は概ね同等であると思われる。MMSEは認知機能の基本的評価を行うための30点満点の尺度で,ADAS-cogは主に認知機能不全の評価を行うための70点満点の尺度である。(ADAS-cogで4点を上回る改善を得るための)治療必要例数(NNT)の推定値は,4-12である16。
メマンチン
複数のメマンチン研究の解析により,メマンチンによる認知機能を改善するためのNNTは3-8であることが明らかにされた17。コクラン・レビューでは,中等度から重度のADにおいて6ヵ月の時点でわずかながら有益性が得られると結論付けられた。軽度から中等度の認知症患者に対して認められた認知機能への効果は,血管性認知症患者では臨床的に検出されず,AD患者でもわずかであった17。
2020 年の後方視的試験18 では,コリンエステラーゼ阻害薬とメマンチンの「実臨床」での効果が検討された。この試験の結果,一般的にMMSEおよびモントリオール認知評価尺度の最初の低下は,薬物療法開始の約2年前に生じていることが示された。薬剤の処方によって,認知機能はその後2-5ヵ月間安定する。投薬開始時に認知機能の障害が大きい患者の方が薬物治療の効果は大きく,抗精神病薬を服用中の患者では薬物治療の効果が小さくなる。重要なことに,最低1回薬剤を切り替えた患者は,薬物療法開始前の速度で機能が低下し続ける傾向にあるため,薬物介入の有益性を認めないようである。全体的に,患者の68%が治療に反応して認知機能が安定する期間があり,その後,薬物治療前の速度で機能が低下し続ける。
認知症に使用される薬剤間の切り替え
AChE-Iの有益性は,投与を中断すると急速に失われ19,再開しても完全には元に戻らない可能性がある20。ある薬剤に対する忍容性が不良であるからといって,他の薬剤に対する忍容性も同様とは限らない21。最近改訂された英国精神薬理学会(BAP)の認知症ガイドラインでは,過去の比較試験でAChE-I 3剤の有効性に一貫した有意差は示されておらず,認められた主要な差は有害事象の頻度と種類であったことが確認されている。よって,同ガイドラインではかなりの割合(最大50%)の患者において,あるAChE-Iが忍容されない場合の別のAChE-Iへの切り替えは,忍容可能かつ有益であろうと推奨しているが,これは依然として適切である22。
ドネペジル中止後に生じた中断症候群が数例報告されており23, 24,可能な限り漸減してから中止すべきであることが示唆される。ただし,ドネペジルからメマンチンへの切り替えについて,即時切り替えと段階的切り替えを比較した研究では,即時切り替え群の患者では段階的切り替え群の患者よりも副作用の発現頻度が高かったものの(46% vs 32%),副作用に臨床的に意義のある差は認めなかった25(リバスチグミン貼付剤への切り替えについては,後述の「忍容性」の項を参照)。AChE-I間の臨床での切り替え方法については,文献のシステマティック・レビュー26に基づいて次のように提案されている。忍容性が得られない場合には,最初の薬剤中止後に副作用が完全に消失してから,別の薬剤投与に切り替えるべきである。有効性欠如の場合にはすぐに切り替えてもよく,その後早めに増量する。別のAChE-Iへの切り替えは,治療を開始してから数年経過し,すでに有益性がなくなっている患者に対しては推奨されない。
その他の効果
AChE-Iは,ADおよび他の認知症の認知機能以外の側面にも作用するかもしれない。複数の研究で,認知症の認知機能以外の症状の管理におけるAChE-Iの安全性および有効性が検討されている。これらの症状の管理に関する情報は,本Chapterの「認知症の行動・心理症状(BPSD)への対応」の項を参照のこと。
投与方法と剤形
用法・用量の設定に関する情報は表6.1を参照のこと。
リバスチグミン経皮貼付剤(9.5mg/24時間)は,6ヵ月間の二重盲検プラセボ対照無作為化試験(RCT)27で最高用量のリバスチグミンカプセルと同等の有効性を示し,忍容性プロファイルは優れていた。この結果は中国の試験でも確認されている28。リバスチグミンの点鼻スプ レー薬も開発中である29。
FDAは,第3相試験の肯定的な結果に基づき,中等度から重度のADに対する1日量がより高いドネペジル徐放性製剤(23mg)を承認した。ドネペジル23mg/日は現在米国とアジアの一部で販売されている。中等度から重度のAD患者を対象とした国際第3相試験で,ドネペジル23mg/日による認知機能への効果はドネペジル10mg/日と比較して有意に大きく,治療前後におけるSevere Impairment Battery(SIB)スコアの平均変化量は被験者全体で2.2点の改善,重度AD患者で3.1点の改善であった。ドネペジル10mg/日から23mg/日への増量では消化器系副作用の発現率が上昇することから,用量増加にはいくらか困難を生じる。消化器系副作用は1ヵ月を超えて持続することはほぼない。段階的な漸増戦略を用いることで消化器系副作用に対処できる場合があり,10mg 1錠に5mg 1錠を追加して1日1回1ヵ月間投与した後,23mg 1錠を1日1回あるいは10mg 1錠と23mg 1錠を隔日で交互に投与することで,1-2ヵ月かけて用量を10mgから23mgに増量してもよいだろう。23mg/日への漸増を成功させるための最適な増量戦略を決定するようデザインされた韓国の研究がある30。患者選択(AD重症度,低用量ドネペジルの忍容性,禁忌がないこと),増量のための段階的漸増戦略,およびAD患者の管理における患者と介護者の適切なモニタリングとカウンセリングの重要性が,臨床的推奨事項として強調されている30。
メマンチン28mg 1日1回徐放(ER)カプセル製剤は2010年に米国で承認され,現在は広く利用可能である。その有効性は大規模多国間第3相試験で明らかにされており,同試験ではAChE-Iによる現行の治療にメマンチンERを追加することで,AChE-I単剤治療と比較して,認知機能や全般的状態の評価項目を含む主要転帰が良好だったことが示されている。有害事象で頻度が高かったのは頭痛,下痢,浮動性めまいであった31。
ドネペジルとメマンチンの高用量は英国およびその他の多くの国ではまだ承認されていないことには注意が必要である。さらに,受診に訪れるADを有する高齢患者の大半は,臨床試験に参加した患者より脆弱でより多くの併存症を有している可能性が高いため,高用量に対する忍容性が高くない可能性がある。
併用療法
AChE-Iとメマンチンの併用療法の利点を検討した試験も行われ,その結果に相反するものもあるが,欧州神経学会(EAN)ガイドラインおよび英国国立医療技術評価機構(NICE)1は,中等度から重度のAD患者に対しAChE-I単剤療法よりもAChE-Iとメマンチンの併用療法を推奨している。ただし,この推奨を支持するエビデンスはやや弱い32。AChE-Iとメマンチンの間に薬物動態学的あるいは薬力学的相互作用はないことが,研究で確認されている33, 34。
忍容性
AChE-Iの忍容性は薬剤によって異なると考えられるが,ここでも直接比較のデータがないため,決定的な結論を出すことは難しい。忍容性全体については,臨床試験の中止例数を参考におおまかに評価することが可能である。臨床試験における中止率は,ドネペジルが4-16%35, 36(プラセボ1-7%),リバスチグミンが7-29%37, 38(プラセボ7%),ガランタミンが7-23%39-41(プラセボ7-9%)である。これらの数字は,特に副作用に伴う中止に関するものである。有害必要数(NNH:number need to harm)は12と報告されている16。フランスのファーマコビジランスデータベースの研究では,AChE-Iに対する重篤な反応に関連する因子として,年齢,抗精神病薬,降圧薬,消化管および代謝を標的にした薬剤の使用が挙げられている42。
忍容性は,漸増の速度や,より不明確ながら投与量の影響を受けると思われる。試験では副作用のほとんどが漸増期に生じているため,臨床で用いる際にはより緩徐な漸増スケジュールが推奨される。そうすれば,臨床におけるこれら薬剤の忍容性はいずれも同程度に良好であると思われる。
リバスチグミン貼付剤は利便性が高く,カプセルに比べて忍容性プロファイルも優れていると考えられる27, 28。3件の試験データでは,リバスチグミン貼付剤はカプセルよりも忍容性が優れ,消化器系副作用やこれらの副作用による投薬中止が少ないことが示されている43。 高用量のリバスチグミンカプセル(6mg/日超)を服用中の患者では,9.5mg/24時間の貼付剤に直接切り替えることが推奨される一方,低用量(6mg/日以下)を服用中の患者では,4.6mg/24時間の貼付剤から開始すべきで,それを4週間投与し,その後9.5mg/24時間の貼付剤に増量することが推奨されており,これらはデータでも支持されている。後者の方法は,他の経口AChE-Iからリバスチグミン貼付剤に切り替える患者にも推奨される(副作用に敏感な患者,極端な低体重患者,徐脈の既往がある患者では1週間の休薬期間をとること)44。9.5mg/24時間の貼付剤を6ヵ月間使用後,忍容性があり,かつ臨床的に意味のある認知的または機能的低下が認められる場合には,13.3mg/24時間の貼付剤への増量を検討してもよい。48週間のRCTでは,9.5mg/24時間貼付剤と比較して,より力価の高い貼付剤(13.3mg)では手段的日常生活動作(IADL)悪化が有意に軽減し,また忍容性も良好であったことが示されている45。
患者と介護者は,リバスチグミン貼付剤の使用に関する重要事項(以下)について,指示を受けるべきである9。
- 経皮貼付剤は,赤くなった皮膚,敏感な皮膚,切傷のある皮膚に使用しないこと。
- 皮膚の炎症リスクの可能性を最小限にするため,14日間以内の同一部位への貼付を避けるべきである。
- 前日貼った貼付剤は,新しい貼付剤を貼る前に毎日必ず外す。
- 貼付剤は1回につき1枚を使用する。
- 貼付剤は小さく切ってはならない。
AChE-Iの使用に際し,喘息,慢性閉塞性肺疾患(COPD),洞不全症候群,上室性伝導障害,消化性潰瘍の易罹患性,けいれん発作の既往,下部尿路閉塞がある患者については注意が必要である。また,リバスチグミン貼付剤の使用時,貼付ミスにより致命的な過量投与のリスクがある46。
メマンチンは忍容性が良好と思われ47, 48,警告が出ている症状には肝機能障害とてんかん/けいれん発作等がある49(投与量の調整が必要な腎障害を有する患者への投与は,BNFまたは同等のガイダンスを参照のこと)。メマンチンとワルファリンとの併用投与時,国際標準比(INR)の上昇を認める複数の孤発症例が報告されている。
副作用
アセチルコリンエステラーゼ阻害薬
AChE-Iによる副作用は概ね予測可能であり,コリン作用系が過度に刺激されると,悪心,嘔吐,浮動性めまい,不眠,下痢を生じることがある50。こうした副作用は治療開始時または増量時に最も起こりやすい。また用量依存性であり,一過性の傾向がある。尿失禁も報告されている51。有害事象の種類や頻度に関して,薬剤間に重大な違いはないと思われるが,臨床試験では,ドネペジルは有害事象の発現頻度が比較的低いことが示唆されている。ただしこれは,単に他の薬剤の試験における漸増スケジュールが急激であったためかもしれない。臨床試験では,リバスチグミン経口薬の消化器系副作用は,他のAChE-Iよりも多いようであったが,漸増ペースを緩やかにする,リバスチグミン経口薬を食事とともに服用する,または貼付剤を使用することにより,消化器系副作用のリスクは低減する。
16年間のVigiBaseによる個別症例安全性報告の解析によると,よく報告されるAChE-Iの副作用は神経精神症状(31.4%),胃腸障害(15.9%),一般・全身障害および投与部位の状態(11.9%)であった。心血管系副作用は11.7%に認められた52。
薬理作用の点から考えると,AChE-Iは心拍数に対して,迷走神経の活動を亢進させる(徐脈を生じさせる)働きをする可能性がある(図 6.1 参照)。この作用が特に重要な意味を持つと思われるのは,「洞不全症候群」や洞房ブロック,その他の房室ブロック等の上室性心伝導障害を有する患者である7-12。
図6.1 AD患者におけるAChE-I治療前および治療中の心血管リスク管理に関するガイドライン53, 54
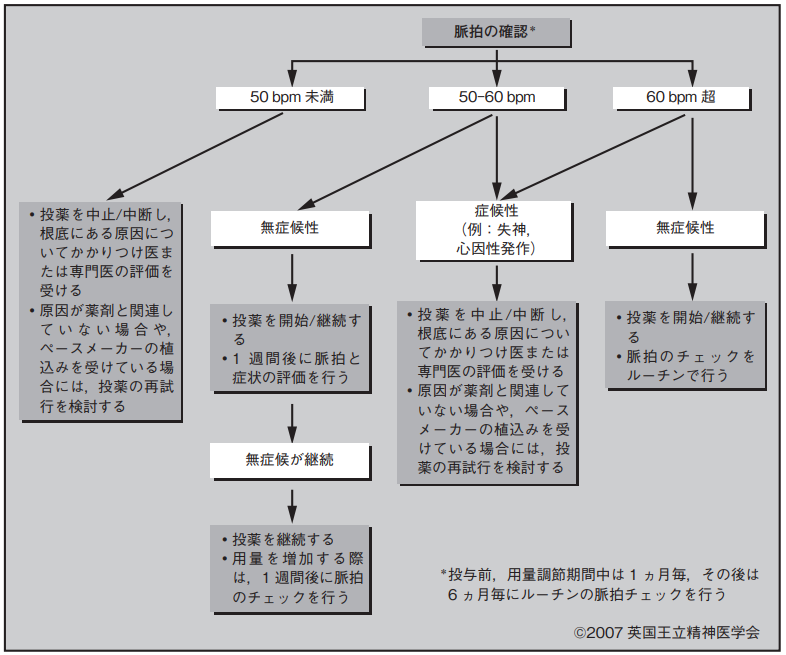
bpm:1分毎の心拍数。薬,薬剤とは選択されたAChE-Iを指す。
許可を得て複製。
AChE-Iによる心臓に対する副作用の可能性が懸念されるようになったのは,軽度認知障害(MCI)を対象としたガランタミンの対照試験で,ガランタミン投与群の死亡率がプラセボ投与群に比べて上昇した(ガランタミン群1.5% vs プラセボ群0.5%)という結果が示されてからである55。特定の主要な死因がみられたわけではないが,報告された死亡例の半数は心血管死であった。この結果を受けて,FDAはMCI患者に対するガランタミンの使用を制限するよう,警告を発表した。ADにおける関連性は不明である56。AChE-IのRCTの集積データを検討したコクラン・レビューにより,AChE-I群ではプラセボ群に比べ失神の発現率が有意に高いことが明らかになった(3.43% vs 1.87%)。カナダのオンタリオ州に住む高齢者140万人の医療記録を検討したcase-time-controlデザインによる集団研究では,AChE-I治療が徐脈による入院リスクの倍増と関連することが示された(半数以上の患者では退院時にAChE-Iの投与が再開されており,臨床医はAChE-Iの心血管毒性を過小評価していることが示唆された)57。レビー小体型認知症患者では,原疾患に関連する自律神経不全があるため,AChE-Iの徐脈性不整脈の副作用の影響を受けやすくなると思われる58。同様の研究で,AChE-Iの投与を受けている患者は対照被験者に比べて失神による受診頻度も高いことが示されており,AChE-I群では1,000人/年あたり31.5回であったのに対し,対照群では18.6回であった(補正後ハザード比1.76)59。
このため,AChE-I 3剤の製薬会社はいずれも,心血管疾患を有する患者や,ジゴキシン,β遮断薬など心拍数を低下させる薬剤を併用している患者へは慎重に投与するよう勧告している。投与前心電図検査(ECG)を必須化すべきとの考えもあるが56,公表されているエビデンスのレビューによれば,心血管系副作用の発現率は低く,重篤な副作用は稀であることが示されている。さらに,ECGを投与前にスクリーニングとして行うことやルーチンで行うことの有用性は不確かであるため,現在,NICEでは推奨されていない。ただし,心血管疾患の既往のある患者や陰性変時作用薬とAChE-Iを併用する患者では,ECGが推奨される[Yorkshire and the Humber Clinical Networks のガイドライン The Assessment of Cardiac Status Before Prescribing Acetyl Cholinesterase Inhibitors for Dementia(2016)53を参照]。
ADの高齢患者204例を対象とした試験では,AChE-I投与開始前と開始後にECGと血圧測定を行った。いずれのAChE-Iでも陰性変時作用,不整脈誘発作用,低血圧誘発作用の増加と関連のある薬剤はなかったため,迷走神経刺激作用に基づいて推奨できる薬剤は示されなかった60。同様に,デンマークで行われた後方視的コホート研究61でも,ドネペジル群と他のAChE-I群の間で心筋梗塞(MI)や心不全のリスクにそれほどの差はなかった。実のところ,メマンチンは全死因死亡のリスクが最も高かったが,メマンチンの投与を受けたのは重症度の高い患者であった。スウェーデンのコホート研究62では,AChE-IはAD患者のMIリスクまたは死亡リスクの35%減に関連することが示されており,この関連は用量が増えるに従って強くなった。この観察研究の結果はRCTにより確認することが必要であるが,死亡率の低下を報告している他の観察研究と合致している。
認知症薬の心血管系への影響に関するレビュー63では,AChE-Iに伴う心血管系有害事象はごく稀であるものの,認知症薬が,失神と徐脈のリスクの,小さいが有意な上昇と関連しているというエビデンスが示されている。また,認知症薬投与がQT延長およびトルサード・ド・ポアンを伴う場合があるという数件の報告もある。
メマンチン
メマンチンの心血管系に対する影響についてはほとんどわかっていないが,メマンチン使用に関連した徐脈の発現および心血管生存率の低下が報告されている63。
メマンチンに関する前方視的データの統合解析によると,プラセボ対照試験で報告が多かった副作用は,激越(メマンチン7.5% vs プラセボ12%),転倒(6.8% vs 7.1%),浮動性めまい(6.3% vs 5.7%),事故による外傷(6.0% vs 7.2%),インフルエンザ様症状(6.0% vs 5.8%),頭痛(5.2% vs 3.7%),下痢(5.0% vs 5.6%)であった64。
フランスのファーマコビジランスデータベースの解析では,ドネペジルとメマンチンの副作用が比較されている。ドネペジル単剤とメマンチン単剤で最も発現率が高い副作用は,それぞれ,徐脈(10% vs 7%),脱力(5% vs 6%),けいれん(4% vs 3%)であった。ドネペジルは徐脈,メマンチンはけいれん発作をしばしば伴うことがよく知られているが,この解析結果から,メマンチンでも徐脈,ドネペジルでもけいれん発作を誘発する可能性もあることが示唆される。したがって,徐脈またはてんかんの既往のある認知症患者の治療は慎重に行わなければならない65。
相互作用
現在販売されているコリンエステラーゼ阻害薬は,相互作用の可能性の点でもそれぞれ異なると考えられる。ドネペジル66とガランタミン67は,シトクロム2D6と3A4で代謝されるため,これらの酵素の働きに影響を及ぼす他の薬剤を用いると,薬物濃度が変化する可能性がある。理論上の推測ではあるが,コリンエステラーゼ阻害薬自体が他の薬剤の代謝を阻害する可能性もある。リバスチグミンは作用部位で代謝され,肝シトクロムに影響を及ぼすことはないため,相互作用の可能性はほとんどない。リバスチグミンと高齢者集団でよく処方される他の薬剤(22種類の薬効分類)との潜在的相互作用に関する前方視的薬力学的解析で,副作用のオッズ比がリバスチグミンとプラセボの間で比較された。その結果,リバスチグミンはプラセボと比較して,薬物相互作用を示唆する副作用の有意な増加パターンは認められなかった68。そのためリバスチグミンは,問題となる薬物相互作用が発現する可能性が最も低いと思われる。これは多剤併用療法を受けている高齢者集団にとって重要な因子であろう(表6.2参照)。
フランスのファーマコビジランスデータベースの解析によると,AChE-Iに関する薬物相互作用の報告の大半は薬力学的な性質のものであり,AChE-Iと徐脈作用のある薬剤(β遮断薬,ジゴキシン,アミオダロン,カルシウムチャネル拮抗薬)の併用に関係することが最も多かった。こうした相互作用の1/3近くは,徐脈や房室ブロック,低血圧等の心血管系副作用を引き起こしていた。次に薬物相互作用の報告が多かったのは,AChE-Iと抗コリン薬の併用による薬理学的拮抗作用であった69。
最近発表された2件の包括的なレビューで,認知症に使用する薬剤の薬力学的,薬物動態学的,薬理遺伝学的側面がまとめられている70, 71。
表6.2 薬物相互作用8-12, 74, 75
| 薬剤 | 代謝 | 本剤の血漿中濃度を上昇させる薬剤 | 本剤の血漿中濃度を低下させる薬剤 | 薬力学的相互作用 |
| ドネペジル (Aricept®) |
CYP3A4とCYP2D6の基質 | ケトコナゾール イトラコナゾール エリスロマイシン キニジン fluoxetine パロキセチン |
リファンピシン フェニトイン カルバマゼピン アルコール |
抗コリン薬および競合的神経筋遮断薬(例:tubocurarine)との拮抗作用。 脱分極性神経筋遮断薬(例:succinylcholine)等のコリン様作用薬,コリン作動薬,末梢作用型コリンエステラーゼ阻害薬(例:ネオスチグミン)との相乗作用の可能性がある。心伝導に対するβ遮断薬,アミオダロン,カルシウムチャネル遮断薬との相加作用の可能性がある。QT 延長および/またはトルサード・ド・ポアンを誘発する薬剤との併用は慎 重に行う 抗精神病薬およびコリンエステラーゼ阻害薬の併用で運動障害,神経遮断薬悪性症候群の発現が認められている 抗てんかん薬の併用によりけいれん発作閾値が低下することがある |
| リバスチグミン (Exelon®) |
肝代謝を受けない | 代謝相互作用の可能性はほとんどないと思われる リバスチグミンは,ブチリルコリンエステラーゼを介したコカイン等の他の物質の代謝を阻害する可能性がある 喫煙によりリバスチグミンのクリアランスが上昇する |
抗コリン薬および競合的神経筋遮断薬(例:tubocurarine)との拮抗作用。脱分極性神経筋遮断薬(例:succinylcholine)等のコリン様作用薬,ベタネコールなどのコリン作動薬,ネオスチグミンなどの末梢作用型コリンエステラーゼ阻害薬との相乗作用の可能性がある。心伝導に対するβ遮断薬,アミオダロン,カルシウムチャネル遮断薬との相乗作用 QT 延長および/またはトルサード・ド・ポアンを誘発する薬剤との併用は慎重に行う。抗精神病薬およびコリンエステラーゼ阻害薬の併用で運動障害,神経遮断薬悪性症候群の発現が認められている。メトクロプラミドとの併用は錐体外路症状のリスク上昇につながるおそれがある |
|
| ガランタミン (Reminyl®) |
CYP3A4 と CYP2D6 の 基質 |
ケトコナゾール エリスロマイシン リトナビル キニジン パロキセチン fluoxetine フルボキサミン アミトリプチリン |
既知の薬剤なし | 抗コリン薬および競合的神経筋遮断薬(例:tubocurarine)との拮抗作用。脱分極性神経筋遮断薬(例:スキサメトニウム)等のコリン様作用薬,コリン作動薬,ネオスチグミンなどの末梢作用型コリンエステラーゼ阻害薬との相乗作用の可能性がある。強い心拍数抑制作用を持つ薬剤(例:ジゴキシン,β遮断薬,一部のカルシウムチャネル遮断薬,アミオダロン)との相互作用の可能性がある。QT延長および/またはトルサード・ド・ポアンを誘発する薬剤との併用は慎重に行う(製薬会社はこのような症例に対しECGを推奨している) 抗精神病薬およびコリンエステラーゼ阻害薬の併用で運動障害,神経遮断薬悪性症候群の発現が認められている |
| メマンチン (Exiba®) |
ほとんど肝代謝を受けない 腎で排出される |
シメチジン ラニチジン プロカインアミド キニジン キニーネ ニコチン トリメトプリム ワルファリンとの併用でINRが上昇した単発症例の報告がある(プロトロンビン時間またはINRの綿密な監視が勧められる) 尿をアルカリ化する(約pH8)薬剤(例:炭酸脱水素酵素阻害薬,重炭酸ナトリウム)によってメマンチンの腎排泄が減少する可能性がある |
既知の薬剤なし (メマンチンとの併 用でヒドロクロロチアジドの血清中濃度が低下する可能性がある) |
レボドパ,ドパミン作動薬,セレギリン,抗コリン薬の作用を増強させる可能性がある。バルビタール系薬および抗精神病薬の作用が抑制される可能性がある アマンタジン,ケタミン,デキストロメトルファンとの併用は避けること─CNS毒性のリスクが上昇する。フェニトインとメマンチンの併用リスクに関する症例が1件報告されている メマンチンと併用する場合は,鎮痙薬,ダントロレン,バクロフェンの用量調節が必要と思われる co-trimoxazole(ST合剤)またはトリメトプリムとの併用でミオクローヌスおよび錯乱の症例報告が1件ある |
注:この一覧は全薬剤を網羅しているわけではない。上記以外でもCYP3A4やCYP2D6酵素を阻害または増強する薬剤との併用は慎重に行うこと。
CNS:中枢神経,ECG:心電図検査,INR:国際標準化比
治療中止のタイミング
中等度または重度の外来AD患者を対象とした大規模多施設共同試験72が行われ,12ヵ月間のドネペジル投与の長期的な効果について,3ヵ月投与後にドネペジルを中止し,メマンチンと切り替えまたは併用した群と比較している。この結果,ドネペジル投与を続けた場合には認知機能改善が継続し,ミニメンタルステート検査(MMSE)スコアが3点と低い患者にとっても治療効果があることが示された。このことから,AChE-Iの投与は可能な限り長く続けるべきであること,自動的に治療を止めるべきMMSEのカットオフスコアは設けるべきではないことが示唆される。さらに,この試験の副次的解析と事後解析では,中等度から重度のAD患者におけるドネペジル投与の中止により,12ヵ月の治療期間中の介護施設入所リスクが上昇したが,その後3年間の追跡調査期間では差は認められなかった。この結果により,治療継続の有益性が明確に認識できない場合でも,治療中止または継続の決定は中止による潜在的リスクについての情報を得たうえで行うべきである73。
認知症性疾患の経過を通したAChE-Iの効果は十分に解明されているわけではない。その一方で,薬剤が初期に処方されたとき,2-5ヵ月間は認知機能の安定化が達成される可能性を示すエビデンスがある18。 しかし,前述の研究からは,疾患発症から時間が経っている場合でも,投薬中止で有害な結果が生じうることが示唆される。現実的には,おそらく治療の反応には個人差がある。それがまだ十分には解明されていないので,予想することもできない。したがって,AChE-Iの投薬を中止するかどうかは,患者の家族や介護者の見解を考慮して,患者毎に決定すべきである。しかし,使用している薬剤に対して忍容性が良好で患者の身体的健康が安定している場合は,おそらくその薬を継続することが最善であろうというのが,コンセンサスの取れた見解である。認知症治療薬中止のリスクは,治療継続によって生じる副作用およびコストとの釣り合いで検討すべきである95。
これに加え,ADの重症度と,AChE-Iの3剤およびメマンチンの有効性との関連を評価したメタ解析では,メマンチン以外の薬剤の有効性は,どの側面においても認知症の重症度とは関連がないことが明らかになった。機能障害に対するメマンチンの効果は,重度の患者ほど良好であった。この結果から,ADがどのような段階であっても,AChE-Iとメマンチン投与に対する効果が保たれることが明確に示された。したがって薬物療法の効果は重症度と大きくは関連がなく,どのような重症度の患者であっても薬物療法で効果が得られる可能性がある。つまり,重症度を薬物療法の除外基準とすべきではないことを示唆している76。
実臨床での認知症薬物療法中止のガイダンスを以降の項に要約した77。
治療中止の理由
- (治療中止によるリスクとベネフィットについての助言を受けたうえで)患者/介護者が中止を決定する場合
- 患者が服薬を拒否する場合(ただし,本 Chapter の秘密裏の投薬に関する項を参照)
- 患者の服薬遵守に問題があり,合理的に解決できない場合
- 患者の認知的,機能的,あるいは行動的能力低下が治療により悪化している場合
- 忍容できない副作用が発現した場合
- 併存疾患により治療のリスクが大きくなる,あるいは治療が無益となる場合(例:末期疾患)
- 治療を継続しても臨床的に意義のある効果が得られない場合(認知的転帰についての一定のスコア達成や施設への入所ではなく,臨床的判断によるべきである)
- 認知症が重度障害に進行した場合(Global Deterioration Scale の第 7 ステージ:嚥下困難の発症)
(忍容性がない以外の理由で)治療中止を決定した場合には,1-3ヵ月かけて減量しながら著しい機能低下がないかをモニタリングすることが推奨される。機能低下が認められた場合には,治療を元に戻すことを検討すべきである。
NICEによる推奨
認知症に関する NICE のガイドライン78が最近では 2018 年 6 月に改訂された。
アルツハイマー病の治療に関する NICE ガイドラインの要約78, 79
- 軽度から中等度のADの管理には,AChE-Iの3剤,すなわちドネペジル,ガランタミン,リバスチグミンを推奨する。
- AChE-Iに対して忍容性がない場合やAChE-Iが禁忌の場合の中等度ADの管理には,メマンチンを推奨する。重度ADの管理にもメマンチンを推奨する。
- 患者にADの確定診断が下っており,すでにAChE-Iを服用している場合,
- 中等度では,AChE-I にメマンチンを追加することを検討する。
- 重度では,AChE-I にメマンチンを追加する。
- 治療は以下の条件に従って行うべきである。
AChE-Iまたはメマンチンを投与されていない患者については,必要な知識と技能を有する医療従事者の助言を必ず得たうえで,それらの薬剤の処方を開始する。知識と技能を有する医療従事者の例を以下に示す。- 精神科医,老年科医,神経内科医等の二次医療における専門家,および
- AD の診断や治療に関して専門知識・技術を持つ他の医療従事者(かかりつけ医,看護コンサルタント,上級診療看護師等)
- AChE-Iまたはメマンチンの投与開始を決定した場合,1回目の処方は一次医療で行ってもよい。
- 患者にADの確定診断が下っており,すでにAChE-Iを服用している場合は,一次医療での処方者は,専門家の助言を受けずにメマンチンの投与を開始してもよい。
- 地域での薬剤処方や交付および治療の再検討は,薬剤最適化についてのNICEガイドラインに従う80。
- 疾患の重症度のみに基づいてAD患者のAChE-Iの投与を中止しないこと。
- AChE-Iは,調達原価が最も安い薬剤から開始すること(分担治療を開始した場合,必要な1日量および1回分の薬剤費を考慮する)。副作用プロファイル,服薬アドヒアランスの見通し,併存疾患,薬物相互作用の可能性,投与プロファイルに基づき,代替選択肢を検討してもよい。
AD以外の認知症の治療に関するNICEガイドラインの要約78, 79
- 軽度から中等度のDLB患者にはドネペジルまたはリバスチグミンを投与する。
- ドネペジルおよびリバスチグミンに対して忍容性がない軽度から中等度のDLB患者にのみ,ガランタミンの投与を検討する。
- 重度DLBの場合,ドネペジルまたはリバスチグミンを検討する。
- AChE-Iに対して忍容性がない場合やAChE-Iが禁忌の場合のDLBの治療にはメマンチンを検討する。
- 血管性認知症では,併存疾患としてAD,パーキンソン病による認知症,またはDLBが疑われる場合にのみ,AChE-Iまたはメマンチンを検討する。
- 前頭側頭型認知症患者にはAChE-Iおよびメマンチンを投与しないこと。
- 多発性硬化症による認知機能障害の場合,AChE-Iおよびメマンチンは投与しないこと。
- パーキンソン病による認知症の薬物療法による管理指針については,パーキンソン病に関するNICEガイドラインのパーキンソン病による認知症の項を参照のこと。
認知機能障害を引き起こす可能性のある薬剤1
- 一般的に処方される薬剤のなかには,抗コリン作用性負荷を増加させるものがあり,そのため認知機能障害を生じることがあることに留意する。
-
以下のような場合は,抗コリン作用性負荷の増加を伴う薬剤の使用を最小限にすることを検討し,可能なら別の選択肢を検討する。
- 認知症が疑われる患者の診断のために専門医に紹介すべきかどうかを評価する場合
- 認知症を有している患者の薬物療法の再検討時
- 抗コリン作用性負荷を評価するための妥当性が検証されたツールは存在するが,複数のツールのなかで1つを推奨するにはエビデンスが不十分であることに留意する(本Chapterの「認知症の身体症状に対するより安全な処方」の項を参照のこと)。
- 薬物療法の再検討を実施する際のガイダンスとして,薬剤最適化(medicines optimisation)についての NICE ガイドライ ンの薬物療法の再検討(medication review)の項を参照のこと。
注:抗コリン作用による認知機能への影響(AEC)評価尺度は www.medichec.com で利用できる。
その他の治療
(エビデンスの確度がより低い治療)
コクラン・レビューによれば,イチョウ葉はプラセボと比べて副作用が多いわけではなく安全と思われるが,認知症や認知障害に有効だという説得力のあるエビデンスは得られていない。イチョウ葉について行われた試験の多くは規模があまりに小さく,方法が不十分で,出版バイアスも除外できない。コクラン・レビューでは,イチョウ葉の認知症や認知障害に対する臨床的有益性はやや一貫性がなく,説得力に欠けると結論付けられている81。システマティック・レビューでは,200mg/日を超える用量(通常は240mg/日)を少なくとも5ヵ月間投与した場合に有益な効果が得られる可能性があると示された。エビデンスの質が比較的低いことを考慮すると,より頑健なデザインの,多施設大規模RCTが必要である82。複数の報告でイチョウ葉が出血リスクを増加させる可能性が指摘されている83。ドイツではイチョウ葉が広く用いられているが,他の国ではそれほど使用されていない。
コクラン・レビューではADおよび軽度認知障害(MCI)に対するビタミン Eの研究3件を検討している。著者らは,ビタミンEがADやMCIの予防や治療に有効であるというエビデンスはなく,認知症治療におけるビタミンEの役割を明らかにするにはさらなる研究が必要であると結論付けている84。しかし,TEAM-AD試験,すなわち軽度から中等度AD患者613例に対しビタミンE 2,000IU/日を投与するRCTでは,ビタミンE群で,主要評価項目である日常生活動作(ADL)の年間低下率の19%減少が認められた。これは進行の6ヵ月遅延と同等であると著者らは述べている。副次評価項目である,必要な介護時間の増加は,ビタミンE群に比べてプラセボ群が2時間多かった。認知機能またはその他の副次評価項目についての有益性は認められなかった85。AD患者に対してビタミンEを用いた複数の試験では,推奨されている1日の許容用量22.4IUより高い用量でαトコフェロールが用いられてきた。これは,出血性脳卒中,前立腺がん,心不全および比較的高い死亡率のリスク増加などの副作用と相関する。ADに対するビタミンEの有効性を示すエビデンスは限られており,ビタミンEの使用を提案する前に,その有用性が起こりうる副作用を上回るかどうかを比較検討しなければならない86。
コクラン・レビューでは,認知症の有無を問わない任意の高齢者で葉酸を単独投与または葉酸とビタミン B12を併用しても,認知機能を改善するというエビデンスは認められなかったとしている87。しかし,最近のレビューから得たデータによると,ホモシステイン(Hcy)の減少,血管治療,炎症状態の緩和,脳葉酸欠乏の緩和および抗酸化応答によって葉酸の補充が認知機能を改善しうるようで,特にHcy値が高い患者は,葉酸補充が低い血中葉酸濃度を上昇させたと考えられ,葉酸補充に比較的良好に反応した。認知機能を改善させうるのに必要とされる葉酸の至適用量は現在明らかになっていない88。
血中Hcyの上昇は,認知障害の潜在的な危険因子となることが示されている。エビデンスのなかには,ビタミンB補充でHcy値が低下し,認知機能低下が緩和される可能性を示唆しているものもある。最近のメタ解析では,ADまたは認知症の高齢者を対象に,Hcy低下と,それによる認知機能低下の緩和について,葉酸とビタミン B12 および/または B6の有効性が評価された。ビタミンBの補充は血中Hcy値低下に有効であったが,認知機能改善につながってはおらず,血中Hcy値低下によるビタミンB誘導認知機能の改善に関する既存データには,一貫性がないことが示唆されている89。
認知症治療のためのオメガ-3 脂肪酸のコクラン・レビューは,軽度から中等度AD患者計632例について検討した3件の研究を対象としており,オメガ-3多価不飽和脂肪酸のサプリメントを6ヵ月間摂取しても認知機能(学習および理解),日常的機能,生活の質(QOL)および精神的健康に対する有効性が認められなかったことを示している。疾患の全体的重症度評価にも影響を認めなかった。対象とされた研究では副作用の報告が十分行われていないが,健康に対する重大な副作用を記述した研究はなかった90。
AD に対する薬用ニンジンの効果を検討した前方視的非盲検試験では,患者97例を薬用ニンジン群またはプラセボ群に無作為に割り付け,12週間投与を行った後,12週間投与を中止し,その間の認知機能を測定した。薬用ニンジン投与後,ADAS-cogスコアとMMSEスコアが改善し始め,それが12週目まで継続したが,投与を中止すると対照群と同レベルまで低下した91。計259例を対象としたRCT4件の最近のシステマティック・レビューおよびメタ解析では,ADに対する薬用ニンジンの有効性は依然として不明確であることが示された。被験者数が少ないこと,方法論的に質が低いこと,プラセボ対照群がないことが,対象となった試験の主な限界である。今後,薬用ニンジンのADに対する有効性を評価するには,より規模が大きく適切にデザインされた試験の実施が必要である92。
dimebon(または latrepirdine)は非選択的抗ヒスタミン薬で,かつてロシアで承認されたが,商業上の理由で販売中止となった薬剤である。本剤について軽度から中等度のAD患者を対象に安全性,忍容性,有効性が評価されてきた。dimebonは,ブチリルコリンエステラーゼ(BuChE)とアセチルコリンエステラーゼ(AChE)に対する弱い阻害作用,NMDA受容体シグナル伝達経路に対する弱い遮断作用,ミトコンドリア膜透過性遷移孔開口阻害作用を持つ93。最近のコクラン・レビューでは,dimebonは,行動に対しては大きくはないものの有益性が認められるようであるが,軽度から中等度のADの認知的および機能的症状に有益な効果を及ぼさないと結論付けられている94。
天然のヒルジンンは薬用ヒルの唾液腺から分離されたもので,直接トロンビン阻害作用を有し,中国では長年にわたって使用されてきた。84例を対象にドネペジル単剤とドネペジルとヒルジン(3g/日)の併用を評価した20週間の小規模な非盲検RCTにおいて,併用群ではドネペジル単剤群と比較してADAS-cogスコアが有意に低下し,ADLスコアが有意に上昇した。しかし併用群の方がドネペジル群よりも出血と過敏反応がよくみられた(併用群では11.9%と7.1% vs ドネペジル群では2.4%と2.4%)95。臨床的使用を検討する前にヒルジンが出血作用を有する可能性についてさらに検討する必要がある。
フペルジン Aは漢方薬のトウゲシバから分離されたアルカロイドである。強力かつ選択性が高く,可逆的なAChE阻害作用を示し,中国では1994年からADの治療に使用され,米国では栄養補助食品として市販されている。メタ解析では,ADに対してフペルジンA 300-500μg/日を8-24週間投与すると,MMSE(平均変化量は3.5)とADL(効果量は投与期間とともに増加)が有意に改善したことが示された。副作用の大半はコリン作動性の性質を示し,重篤な副作用は認められなかった96。その後のメタ解析でも,不確実ではあるが同様に肯定的な結果が示された97。しかしコクラン・レビューでは,血管性認知症に対するフペルジンAの有用性について説得力のあるエビデンスは認められなかった98。同様に,MCIに対するフペルジンAのコクラン・レビューは,その時点では適切に行われた試験がなかったため,この適応症に対しては現状ではエビデンスが不十分と結論付けている99。しかし,最近のネットワークメタ解析では,軽度から中等度の認知機能低下群において,フペルジンAの良好な有効性が示された100。
サフランのAD管理における有効性を示唆するエビデンスが増えている。RCTを対象にした最近のシステマティック・レビューとメタ解析によると,プラセボに比べてサフランは,ADAS-cogおよびClinical Dementia Rating Scale-Sums of Boxesで測定された認知機能に関して有意な改善を示した。さらに,サフランと既存薬剤(ドネペジルおよびメマンチン)との間に有意差はなかった。サフランは日常生活機能を改善したものの,その変化は統計学的に有意ではなかった。対象となった研究では重篤な副作用は報告されなかった。サフランは,MCI患者およびAD患者の認知機能改善には有益である可能性がある。その他のタイプの認知症に対するサフランの有効性を支持するエビデンスは認められなかった。MCIおよび認知症に対するサフランの有効性と安全性をさらに確実にするには,より質の高い無作為化プラセボ対照試験が必要である101。
cerebrolysinはブタ脳由来ペプチドの非経口製剤で,内因性神経栄養因子に類似した薬力学的特性を示す。軽度から中等度のAD患者を対象に,cerebrolysin 30mg/日とプラセボを比較したRCT6件のメタ解析によると,cerebrolysinは,4週時点における認知機能と,4週および6ヵ月の時点における全般的な臨床的変化および「全般的な効果」に関して,プラセボと比較して有意に有効性が高かった。cerebrolysinの安全性はプラセボと同等であった。さらに,cerebrolysin単独療法,ドネペジル単独療法,および両剤の併用療法を比較した大規模な28週間のRCTでは,最終評価時点で,全般的な転帰に関して,cerebrolysin単独療法および併用療法は,ドネペジル単独療法に比べて有意に高い改善が認められたが,認知的,機能的,行動的な側面に有意な群間差はみられなかった。併用療法群はすべての試験来院時点で,認知機能改善スコアが最良であった102。
血管性認知症におけるcerebrolysinを評価したコクラン・レビューは,2019年に更新された。cerebrolysinの静脈内投与は,副作用を示唆することなく,血管性認知症患者の認知機能および全般的機能を改善させた。しかしこれらのデータは決定的なものではない。この種の解析は不均質さという限界があり,含まれた論文にはバイアスのリスクが高い。cerebrolysinに有益性があるとしても,その効果はあまりに小さく臨床的に意味がない可能性がある。cerebrolysinは血管性認知症の治療薬として使用され続け,販売促進もされ続けるであろうが,この薬剤の使用を支持するエビデンスは弱い。最もよく報告される重篤ではない副作用は,頭痛,無力症,浮動性めまい,高血圧,低血圧であった103。
ADでは,アミロイド蛋白が細胞外プラークの形で沈着し,アミロイド蛋白の生成はコレステロール依存性であることが研究で明らかになっている。高コレステロール血症が血管性認知症の発症に関与することも示唆されている。スタチンはコレステロール低下作用があることから,認知症治療薬として検討されている。しかしコクラン・レビューによれば,認知症の治療にスタチンを推奨するためのエビデンスはなお不十分である。これまでに行われた研究のデータ解析では,スタチンはADAS-cogスコアまたはMMSEスコアなどの評価項目を改善させる効果はないことが示されている104。その後コクラン・レビューでスタチンに認知症予防の効果があるかどうかが検討された。このレビューの対象に適合した無作為化試験は2件のみで,総被験者は26,340例であった。いずれの研究でも,プラセボを投与された患者に比べて,スタチンの投与を受けた患者のADおよび認知症発生率は低下しなかった105。その後行われたシステマティック・レビューとメタ解析では,組み入れ基準を満たした25件の研究を対象として行われた。これによると,スタチンの使用は全種類の認知症,ADおよびMCIのリスクを低下させる可能性が示されたが,血管性認知症の発症率は低下しなかった106。同様に,観察研究のメタ解析では(9,162,509例,研究30件),スタチンの使用は認知症リスク低下に有意に関連していることが示唆された。スタチンを服用した患者における全体的なリスク減少は,ADについては統合リスク比(RR)0.69(95%CI=0.60-0.80,p<0.0001),血管性認知症については統合RR 0.93(95%CI=0.74-1.16,p=0.54)であった。しかし,さらなるエビデンスが確立されるまで,臨床医はスタチンの使用を心血管疾患治療にとどめておくべきであることに留意する必要がある107。
縦断的前方視的研究によって,認知的に健康な高齢者集団を対象にチョコレートの摂取と認知機能低下の関連性が検討された。年齢65歳以上で正常なMMSEスコアを有する計531例の被験者を中央値で48ヵ月間追跡調査した。ベースライン時に食習慣を評価し,ベースライン時とフォローアップ時にMMSEを用いて全般的な認知機能を評価した。交絡因子で調整後,チョコレートの摂取は,認知機能低下のリスク低下と関連していた(RR=0.59,95%CI=0.38-0.92)。この防御効果は,カフェインの1日あたりの平均摂取量が75mg未満の被験者にのみ観察された108。
Souvenaidは初期ADの食事管理として提唱されている医療食である。この飲料に含まれる栄養素は,認知機能改善に効果があると示唆されているが,医療食の栄養機能表示は政府機関で評価されているわけではない。軽度AD患者259例を対象とした24週間の試験では,主要評価項目である記憶複合スコアに関して,Souvenaidは統計学的に有意な有益性を示したが,ADのバイオマーカーとエピソード性の記憶障害を有する被験者を対象とする24ヵ月の試験では,主要評価項目に関して有益性を示さなかった。これらの医療食は安全そうであるものの,全体的にADにおける有効性のエビデンスは弱い86。
idalopirdine は5-HT6受容体拮抗薬である。5-HT6受容体は記憶に関連するCNS領域で発現し,5-HT6受容体の遮断によりACh放出が誘導されることを示唆するエビデンスがあることから,5-HT6 拮抗作用によるACh濃度の回復はコリン作用の低下に対する有望なアプローチとされている109。最近のシステマティック・レビューとメタ解析では,AD患者2,803例を対象とした4件のRCTが解析された。idalopirdineはAD患者に対する有効性を示さず,肝酵素増加と嘔吐のリスクを伴う。idalopirdineは中等度ADのサブグループにおいて,高用量で効果が増す可能性があるが,効果量は小さく,限定的なものになりうる110。
抗炎症薬:AD患者を対象とした抗炎症薬の数多くのRCTで主要評価項目が達成されていない。ADに対するインドメタシン,ナプロキセン,rofecoxib等の非ステロイド性抗炎症薬(NSAIDs)に関する大規模研究でも否定的な結果が示されている。また,プレドニゾロン,ヒドロキシクロロキン,シンバスタチン,アトルバスタチン,アスピリン,rosiglitazoneなど様々な他の抗炎症薬を使ったRCTでは,AD患者において,主要な認知評価項目で臨床的に重要な変化は示されなかった22。2020年のコクラン・レビューでは,認知症予防に対するアスピリンとその他のNSAIDsが評価された。その結果,低用量アスピリンおよびその他のいかなるクラスのNSAIDs(セレコキシブ,rofecoxib,ナプロキセン)についても,認知症予防のための使用を支持するエビデンスは認められなかった。しかし,アスピリンを服用した群では,プラセボ群より高い死亡率および高い重大な出血率など有害な作用を示すエビデンスがあり,複数ある研究の1つでは,プラセボ群に比べてNSAIDs群の方が認知症の発症例が多かった。胃出血および疼痛,悪心,胃炎などその他の胃の問題もNSAIDs群の方で報告が多かった111。
トラゾドンおよび dibenzoylmethane
2つの既存の化合物が,神経変性モデルマウスにおいて,臨床的意義のある用量を長期間投与することで,全身毒性を生じることなく顕著な神経保護作用を得られることが明らかになった。トラゾドンは,セロトニン拮抗・再取り込み阻害作用のある抗うつ薬で,抗不安作用と催眠作用も有するが,ADにおける認知症の行動・心理症状(BPSD)を軽減することが示されている。最近の小規模な後方視的試験では,徐波睡眠を増加させるトラゾドンの長期使用が認知機能低下の遅延と関係するかが検討された。トラゾドン非使用者は,トラゾドン使用者よりMMSE(主要評価項目)の低下速度が2.6倍速かった。事後解析によると,観察された効果は睡眠に関する症状の主観的な改善と特に関連していた。研究結果は,トラゾドンの使用と認知機能低下遅延との間の関連を示唆しているが,この関連が,因果関係にあるのか,それとも(徐波睡眠の増加によってもたらされた)睡眠障害の改善等,その他の因子の間接的なマーカーなのかは,今後研究を行って確認していかなければならない112。
dibenzoylmethane(DBM)は,抗腫瘍作用を有し,前立腺腫瘍および乳腺腫瘍に対する有効性が認められるカンゾウの微量成分である。トラゾドンとDBMはいずれも,プリオン病モデルマウスにおいて記憶障害を回復させ,神経学的徴候を抑制し,神経変性を予防し,生存期間を有意に延長させた。また,両剤はタウオパチー/前頭側頭型認知症モデルマウスにおいて神経保護作用を示し,記憶障害を回復させ,海馬萎縮を軽減させた。さらに,トラゾドンはp-tau量を減少させた。そのためトラゾドンとDBMは認知症の新しい疾患修飾薬となる可能性がある113。これまでにトラゾドンが認知症のリスクを軽減させることを示唆する観察研究のデータはないが,高齢者における重大な有害転帰を示唆するデータはいくつか存在する114。
新規治療
以下のようにいくつかの新薬についてADを対象に第3相試験が行われたが,臨床的転帰の改善を示すことはできなかった。
- semagacestat 115はγ-セクレターゼ阻害薬である。AD患者3,000例を対象とした試験は,実薬群において認知機能改善が認められず,高用量群では対照群と比較して認知機能の悪化を認めたため,2010年に中止された。また,実薬群では対照群と比較して皮膚癌の発生率も高かった116。
- solanezumab はヒト化モノクローナル抗体であり,可溶型アミロイドに結合して脳からのクリアランスを促進する117。軽度AD患者2,129例を対象としたRCT(EXPEDITION3)では,solanezumab 400mgの4週毎の投与は,認知機能低下に有意な有効性を認めなかった118。
- bapineuzumab はヒト化抗アミロイドβ(Aβ)モノクローナル抗体である119。bapineuzumabのRCTに関して2017年に行われたメタ解析では,臨床上の有用性がないことと,重篤な副作用(血管原性浮腫)との相関が確認された。bapineuzumabは高用量で,滲出または浮腫を伴うアミロイド関連画像所見異常の率が比較的高いことから,これらの研究で使用されたbapineuzumabの用量は制限された。軽度から中等度AD患者に対するbapineuzumabの使用は推奨されない120。
aducanumab はAβを標的とすることで作用する抗体で,凝集したAβと選択的に結合する。この相互作用を介して,aducanumabはAβの蓄積を減少させ,脳内に存在するアミロイドプラークの数も減り,神経変性や疾患進行を遅らせる可能性がある。2019年前半に,製薬会社(バイオジェン)は,2件の同一デザインの第3相AD試験において,aducanumabは無益性解析の結果が芳しくなく,その開発を中止すると発表したが,その年の後半に米国FDAに市販承認を申請したと発表した。同社の説明によると,無益性解析のカットオフ日後に研究のなかで投与を続けていた患者を対象とした試験のデータを再解析したところ,1つの試験が有意な結果を示し,もう1件の試験からのサブセットはその肯定的な結果を支持していたと説明した121。外部専門家パネルによるそのデータの最近のレビュー結果は有望ではなかったものの,FDAは2021年3月までに,aducanumabを承認するかどうか最終的な決定を発表する予定である。
Aβを標的とする治療法は,30年近くも研究の対象になってきた。しかし,強く期待された複数の薬剤が第3相試験で臨床的な有用性を示すことができなかった。バイオジェンによって示されたaducanumabに対する肯定的な結果は,完全に明確というわけではなく,その妥当性を確認するためにさらなるデータが必要である。したがって,研究者は,タウ蛋白がAβより認知機能低下の重症度とより密接に相関しているように思われるため,タウ標的療法へと方針転換をしている。現在,臨床試験が行われている抗タウ薬の大半は免疫治療薬で,それらは臨床試験の初期段階にある。4つの抗タウモノクローナル抗体(gosuranemab,tilavonemab,semorinemab,zagotenemab)と抗タウワクチン(AADvac1)がこれまでのところ第2相試験に到達している122。
血管性認知症(VaD)
血管性認知症(VaD)は,認知症例全体の10-50%を占めることが報告されており,ADの次に多いタイプの認知症である。VaDは虚血性の脳損傷によって生じ,認知機能の障害や行動障害を伴う。現時点では管理の選択肢はほとんどなく,基礎にある脳血管疾患の危険因子のコントロールに重点が置かれている123。
ここで留意すべきなのは,VaDかアルツハイマー型認知症かを確実に診断することは不可能であり,認知症の多くは複合的な原因によって生じるということである。これが,VaDであることが確実と考えられる患者でも,一部のAChE-Iでは常に一貫した結果が得られるとは限らないことの説明になるかもしれない。また認知的転帰の有効性を示すデータは,年齢が比較的高い患者に由来していた。したがって,これらの患者では血管性とアルツハイマー型の混合型認知症を病理とする可能性が高い124。
現在市販されている薬剤のうち,英国でVaDの治療薬として承認されているものはない。VaDの管理については,概要が示されている125, 126。脳卒中の場合とは異なり,スタチンによる高脂血症の治療,アセチルサリチル酸による血液凝固異常の治療がVaDの発症や進行に対して効果があることを裏付ける確実なエビデンスはない127。同様に,コクラン・レビューでもスタチンがVaDの治療に役立つことを支持する研究はないとされている105。血管性認知障害に対するドネペジルに関するコクラン・レビューでは,6ヵ月間投与後の認知機能,臨床全般印象評価尺度,ADLの改善効果を支持するエビデンスが認められている128。血管性認知障害に対するガランタミンに関するコクラン・レビュー129, 130によると,認知機能および全般的な臨床状態についてプラセボを上回る効果があることを示すデータは限られている。ガランタミンの試験では,消化器系副作用の高い発現率が報告された。血管性認知障害に対するリバスチグミンに関するコクラン・レビューでは,効果があるとするいくつかのエビデンスが認められたが,この結論は1件の大規模試験から引き出されたものであり,リバスチグミンの副作用のため治療を中止する患者の割合が顕著だった105, 131。さらに,RCTのメタ解析では,AChE-Iおよびメマンチンによる認知機能改善効果はわずかであり,その臨床的意義は不確かであるという結果が示されており,VaDにこれらの薬剤を広く使用するには裏付けとなるデータが不足していると結論付けられている123。最近行われたシステマティック・レビューおよびベイジアンネットワークメタ解析では,血管性認知障害の治療のための認知機能改善薬の有効性と安全性が比較され,認知機能に関してはドネペジル,ガランタミン,およびメマンチンで有意な有効性が認められた。メマンチンは全般状態において有意な有効性があることが示された。いずれも安全で忍容性は良好であった132。VaDおよびその他の血管性認知障害に対するコリンエステラーゼ阻害薬を対象としたシステマティック・レビューについては,新たなコクラン・レビューが現在進行中である。
レビー小体型認知症(DLB)
レビー小体型認知症(DLB)は,認知症症例全体の15-25%を占める可能性が示されてきた(剖検ではこれより大幅に低い割合を示唆しているが)。特徴的な症状として,認知能力の変動を伴う認知症,初期から持続する幻視,パーキンソン症候群の自発運動が挙げられる。転倒,失神,一過性の意識障害,神経遮断薬に対する感受性,種々の幻覚も高頻度でみられる133。
2018年に更新されたNICEガイドラインでは1,DLBに対してコリンエステラーゼ阻害薬とメマンチンの使用を推奨している(NICEガイドラインの概要の表を参照のこと)。
リバスチグミンとドネペジルの臨床試験のメタ解析では,認知機能改善,全般的な機能とADLの改善が認められ,AChE-Iで改善しなかったとしても投与中に悪化する可能性が低いことから,DLBへのAChE-Iの使用を支持している。DLBに対するメマンチンの有効性は,AChE-Iに比べて明確性に欠けるが忍容性は良好で,単独療法またはAChE-Iの補助薬として有用である可能性がある134。
DLB患者の管理はかなり複雑である。症状が各患者によって様々なだけでなく,同じ患者でも時間経過とともに症状が変化していくことがある。1つの症状に対して有効な薬剤が別の症状を悪化させることもあるため,疾患管理が困難である。症状は様々な専門家によって個別に管理されることが多く,そのために質の高いケアの実施が困難になる。臨床研究およびメタ解析によって,DLB患者の認知的症状,神経心理学的症状,運動的症状の治療のためのエビデンスが現在示されている。さらに,専門家からの一致した意見として,(自律神経障害等)共通した症状の管理のために,パーキンソン病等の類縁疾患に対する治療薬のDLB患者への使用が支持されている。しかし,いまだエビデンスの不足している部分があるため,今後はDLB患者に特異的な症状の治療に焦点を絞った臨床研究が必要である135。
DLBに特異的な症状管理に役立つ指針は,「Management of Lewy body dementia Summary sheets - Diamond Lewy」を参照のこと136。
軽度認知障害(MCI)
MCIは,認知症の臨床的前段階として提唱された概念であるが,様々な予後の患者の混成群である。MCIに対するAChE-Iの安全性と有効性を評価したコクラン・レビューでは,AChE-Iは認知症への進行を抑制したり認知機能検査のスコアを改善したりするというエビデンスはほとんどないとされている。この弱いエビデンスに加え,副作用,特に消化器系副作用のリスクが高い。つまり,MCIに対してAChE-Iの投与は推奨できないとされる137。システマティック・レビュー138では,MCIに対してAChE-IやNSAIDsであるrofecoxibを含むどのような治療も,再現可能なエビデンスをもって有効といえるものはないとしている。さらに,1件のシステマティック・レビューおよびメタ解析では,AChE-IはMCIの治療にわずかに有効性を示したが,安全性の問題が多く認められたため,MCIの治療薬としての推奨は難しいとしている139。様々な国の専門家らが最近,MCIの薬物および薬物以外の治療法について利用可能なエビデンスのレビューを行った140。
他の認知症
前頭側頭型認知症に関するRCTのシステマティック・レビューでは,一部の薬剤(例:SSRI,トラゾドン)が行動的症状の軽減に有効である可能性が示されているが,いずれも認知機能に対する作用はない141。
コクラン・レビューにより,神経疾患に伴う稀な認知症に対するAChE-Iの有効性と安全性が評価されている。大部分の試験は被験者数が非常に少なく,AChE-Iは消化器系副作用の頻度がプラセボよりも高かったが,認知機能とADLにおける有効性は不明確であった142。
BAP22による抗認知症薬の臨床治療ガイダンスのまとめ(表6.3)
AChE-Iおよびメマンチンは,幅広い重症度のADに有効である。スタチン,抗炎症薬,ビタミンE,栄養補給剤,イチョウ葉を含めたその他の薬剤はADの治療または予防には推奨できない。AChE-IもメマンチンもMCIには有効ではない。AChE-Iは前頭側頭型認知症には有効ではなく,激越を起こす可能性がある。AChE-Iはレビー小体病患者(パーキンソン病型認知症およびDLB)に使用することができ,メマンチンも有用かもしれない。混合型認知症にはAChE-Iが有効であるが,VaDに対する明らかな有効性を示す薬剤はない。初期のエビデンスでは,多元的介入により認知症を予防する,あるいは発症を遅らせる可能性が示唆されている。AD患者またはAD発症リスクが高い人を対象としたアミロイドおよび/またはタウ沈着を軽減する戦略に関する数多くの新規薬物療法の研究が進行中である。初期のAD患者(前駆的/軽度)を対象とした中核となるような試験の結果が待たれるが,現時点では,より進行したAD患者(軽度から中等度)においての効果ははっきりせず,承認や臨床使用の推奨が得られている疾患修飾薬は存在しない。
表6.3 BAP による推奨の要約
| 第一選択 | 第二選択 | |
| アルツハイマー病 | AChE-I | メマンチン |
| 血管性認知症 | なし | なし |
| 混合型認知症 | AChE-I | メマンチン |
| レビー小体型認知症 | AChE-I | メマンチン |
| 軽度認知障害 | なし | なし |
| パーキンソン病に伴う認知症 | AChE-I | メマンチン |
| 前頭側頭型認知症 | なし | なし |
aducanumab はその後,2021年6月,FDAに承認されたが,同時に追加試験の実施も求めており,その結果次第では承認が取り消される可能性もあるとしている。
(多田 光宏)
参照文献
- National Institute for Clinical Excellence. Dementia: assessment, management and support for people living with dementia and their carers. NICE guideline [NG97] 2018; www.nice.org.uk/guidance/ng97.
- Francis PT, et al. The cholinergic hypothesis of Alzheimer’s disease: a review of progress. J Neurol Neurosurg Psychiatry 1999; 66:137-147.
- Craig LA, et al. Revisiting the cholinergic hypothesis in the development of Alzheimer’s disease. Neurosci Biobehav Rev 2011; 35:1397-1409.
- Mesulam M, et al. Widely spread butyrylcholinesterase can hydrolyze acetylcholine in the normal and Alzheimer brain. Neurobiol Dis 2002; 9:88-93.
- Weinstock M. Selectivity of cholinesterase inhibition: clinical implications for the treatment of Alzheimer’s disease. CNS Drugs 1999;12:307-323.
- Matsunaga S, et al. Memantine monotherapy for Alzheimer’s disease: a systematic review and meta-analysis. PLoS One 2015;10:e0123289.
- BNF Online. British National Formulary. 2020; https://www.medicinescomplete.com/mc/bnf/current.
- Eisai Ltd. Summary of product characteristics. Aricept tablets (donepezil hydrochloride). 2018; https://www.medicines.org.uk/emc/product/3776/smpc.
- Novartis Pharmaceuticals UK Limited. Summary of product characteristics. Exelon 4.6mg/24h, 9.5mg/24h, 13.3mg/24h transdermal patch. 2020; https://www.medicines.org.uk/emc/product/7764/smpc.
- Sandoz Limited. Summary of product characteristics. Rivastigmine Sandoz 1.5mg, 3mg, 4.5mg, 6mg hard capsules. 2016; https://www.medicines.org.uk/emc/product/8407/smpc.
- Shire Pharmaceuticals Limited. Summary of product characteristics. Reminyl XL 8mg, 16mg and 24mg prolonged release capsules. 2019;-https://www.medicines.org.uk/emc/product/3934/smpc.
- Shire Pharmaceuticals Limited. Summary of product characteristics. Reminyl Oral Solution. 2020; https://www.medicines.org.uk/emc/medicine/10337.
- Lundbeck Limited. Summary of product characteristics. Ebixa 5mg/pump actuation oral solution, 20mg and 10mg Tablets and Treatment Initiation Pack. 2019; https://www.medicines.org.uk/emc/product/8222/smpc.
- NHS Prescription Services. Drug tariff. 2020; http://www.drugtariff.nhsbsa.nhs.uk/#/00791628-DD/DD00791615/Home.
- Buckley JS, et al. A risk-benefit assessment of dementia medications: systematic review of the evidence. Drugs Aging 2015; 32:453-467.
- Lanctot KL, et al. Efficacy and safety of cholinesterase inhibitors in Alzheimer’s disease: a meta-analysis. CMAJ 2003; 169:557-564.
- McShane R, et al. Memantine for dementia. Cochrane Database Syst Rev 2006; CD003154.
- Vaci N, et al. Real-world effectiveness, its predictors and onset of action of cholinesterase inhibitors and memantine in dementia: retrospective health record study. Br J Psychiatry 2020:1-7. [Epub ahead of print].
- Burns A, et al. Efficacy and safety of donepezil over 3 years: an open-label, multicentre study in patients with Alzheimer’s disease. Int JGeriatr Psychiatry 2007; 22:806-812.
- Doody RS, et al. Open-label, multicenter, phase 3 extension study of the safety and efficacy of donepezil in patients with Alzheimer disease. Arch Neurol 2001; 58:427-433.
- Farlow MR, et al. Effective pharmacologic management of Alzheimer’s disease.Am J Med 2007; 120:388-397.
- O’Brien JT, et al. Clinical practice with anti-dementia drugs: A revised (third) consensus statement from the British Association for Psychopharmacology.J Psychopharmacol 2017; 31:147-168.
- Singh S, et al. Discontinuation syndrome following donepezil cessation.Int J Geriatr Psychiatry 2003; 18:282-284.
- Bidzan L, et al. Withdrawal syndrome after donepezil cessation in a patient with dementia.Neurol Sci 2012; 33:1459-1461.
- Waldemar G, et al. Tolerability of switching from donepezil to memantine treatment in patients with moderate to severe Alzheimer’s disease.Int J Geriatr Psychiatry 2008; 23:979-981.
- Massoud F, et al. Switching cholinesterase inhibitors in older adults with dementia.Int Psychogeriatr 2011; 23:372-378.
- Winblad B, et al. A six-month double-blind, randomized, placebo-controlled study of a transdermal patch in Alzheimer’s disease-rivastigmine patch versus capsule.Int J Geriatr Psychiatry 2007; 22:456-467.
- Zhang ZX, et al. Rivastigmine patch in Chinese Patients with Probable Alzheimer’s disease: A 24-week, randomized, double-blind parallel-group study comparing rivastigmine patch (9.5mg/24 h) with Capsule (6mg Twice Daily).CNS Neurosci Ther 2016; 22:488-496.
- Morgan TM, et al. Absolute bioavailability and safety of a novel rivastigmine nasal spray in healthy elderly individuals.Br J Clin Pharmacol 2017; 83:510-516.
- Sabbagh M, et al. Clinical recommendations for the use of donepezil 23mg in moderate-to-severe Alzheimer’s disease in the Asia-Pacific region.Dementia Geriatr Cogn Disord Extra 2016; 6:382-395.
- Plosker GL. Memantine extended release (28mg once daily): a review of its use in Alzheimer’s disease.Drugs 2015; 75:887-897.
- Schmidt R, et al. EFNS-ENS/EAN guideline on concomitant use of cholinesterase inhibitors and memantine in moderate to severe Alzheimer’s disease.Eur J Neurol 2015; 22:889-898.
- Periclou AP, et al. Lack of pharmacokinetic or pharmacodynamic interaction between memantine and donepezil.Ann Pharmacother 2004;38:1389-1394.
- Grossberg GT, et al. Rationale for combination therapy with galantamine and memantine in Alzheimer’s disease.J Clin Pharmacol 2006;46:17S-26S.
- Rogers SL, et al. Donepezil improves cognition and global function in Alzheimer disease: a 15-week, double-blind, placebo-controlled study. Donepezil Study Group.Arch Intern Med 1998; 158:1021-1031.
- Rogers SL, et al. A 24-week, double-blind, placebo-controlled trial of donepezil in patients with Alzheimer’s disease. Donepezil Study Group.Neurology 1998; 50:136-145.
- Corey-Bloom J, et al. A randomized trial evaluating the efficacy and safety of ENA 713 (rivastigmine tartrate), a new acetylcholinesterase inhibitor, in patients with mild to moderately severe Alzheimer’s disease.International Journal of Geriatric Psychopharmacology 1998; 1:55-64.
- Rosler M, et al. Efficacy and safety of rivastigmine in patients with Alzheimer’s disease: international randomised controlled trial.BMJ 1999; 318:633-638.
- Tariot PN, et al. A 5-month, randomized, placebo-controlled trial of galantamine in AD. The Galantamine USA-10 Study Group.Neurology 2000;54:2269-2276.
- Raskind MA, et al. Galantamine in AD: A 6-month randomized, placebo-controlled trial with a 6-month extension. The Galantamine USA-1 Study Group.Neurology 2000; 54:2261-2268.
- Wilcock GK, et al. Efficacy and safety of galantamine in patients with mild to moderate Alzheimer’s disease: multicentre randomised controlled trial. Galantamine International-1 Study Group.BMJ 2000;321:1445-1449.
- Pariente A, et al. Factors associated with serious adverse reactions to cholinesterase inhibitors: a study of spontaneous reporting.CNS Drugs 2010;24:55-63.
- Sadowsky CH, et al. Safety and tolerability of rivastigmine transdermal patch compared with rivastigmine capsules in patients switched from donepezil: data from three clinical trials.Int J Clin Pract 2010;64:188-193.
- Sadowsky C, et al. Switching from oral cholinesterase inhibitors to the rivastigmine transdermal patch.CNS Neurosci Ther 2010;16:51-60.
- Cummings J, et al. Randomized, double-blind, parallel-group, 48-week study for efficacy and safety of a higher-dose rivastigmine patch (15 vs. 10 cm(2)) in Alzheimer’s disease.Dement Geriatr Cogn Disord 2012;33:341-353.
- National Institute for Health and Care Excellence. British National Formulary (BNF). 2020; https://bnf.nice.org.uk.
- Parsons CG, et al. Memantine is a clinically well tolerated N-methyl-D-aspartate (NMDA) receptor antagonist-a review of preclinical data.Neuropharmacology 1999;38:735-767.
- Reisberg B, et al. Memantine in moderate-to-severe Alzheimer’s disease.N Engl J Med 2003;348:1333-1341.
- Jones RW. A review comparing the safety and tolerability of memantine with the acetylcholinesterase inhibitors.Int J Geriatr Psychiatry 2010;25:547-553.
- Dunn NR, et al. Adverse effects associated with the use of donepezil in general practice in England.J Psychopharmacol 2000;14:406-408.
- Hashimoto M, et al. Urinary incontinence: an unrecognised adverse effect with donepezil.Lancet 2000;356:568.
- Kroger E, et al. Adverse drug reactions reported with cholinesterase inhibitors: an analysis of 16 years of individual case safety reports from VigiBase.Ann Pharmacother 2015;49:1197-1206.
- NHS Yorkshire and Humber Clinical Networks. The assessment of cardiac status before prescribing acetyl cholinesterase inhibitors for dementia. Version 1. 2016; http://www.yhscn.nhs.uk/media/PDFs/mhdn/Dementia/ECG%20Documents/ACHEIGuidance%20V1_Final.pdf.
- Rowland JP, et al. Cardiovascular monitoring with acetylcholinesterase inhibitors: a clinical protocol.Adv Psychiatr Treatment 2007;13:178-184.
- FDA Alert for Healthcare Professionals. Galantamine hydrobromide (marketed as Razadyne, formerly Reminyl). 2005; https://www.fda.gov/Drugs/DrugSafety/ucm109350.htm.
- Malone DM, et al. Cholinesterase inhibitors and cardiovascular disease: a survey of old age psychiatrists’ practice.Age Ageing 2007;36:331-333.
- Park-Wyllie LY, et al. Cholinesterase inhibitors and hospitalization for bradycardia: a population-based study.PLoS Med 2009;6:e1000157.
- Rosenbloom MH, et al. Donepezil-associated bradyarrhythmia in a patient with dementia with Lewy bodies (DLB).Alzheimer Dis Assoc Disord 2010; 24:209-211.
- Gill SS, et al. Syncope and its consequences in patients with dementia receiving cholinesterase inhibitors: a population-based cohort study.Arch Intern Med 2009; 169:867-873.
- Isik AT, et al. Which cholinesterase inhibitor is the safest for the heart in elderly patients with Alzheimer’s disease?Am J Alzheimers Dis Other Demen 2012; 27:171-174.
- Fosbol EL, et al. Comparative cardiovascular safety of dementia medications: a cross-national study.J Am Geriatr Soc 2012; 60:2283-2289.
- Nordstrom P, et al. The use of cholinesterase inhibitors and the risk of myocardial infarction and death: a nationwide cohort study in subjects with Alzheimer’s disease.Eur Heart J 2013; 34:2585-2591.
- Howes LG. Cardiovascular effects of drugs used to treat Alzheimer’s disease.Drug Saf 2014; 37:391-395.
- Farlow MR, et al. Memantine for the treatment of Alzheimer’s disease: tolerability and safety data from clinical trials.Drug Saf 2008;31:577-585.
- Babai S, et al. Comparison of adverse drug reactions with donepezil versus memantine: analysis of the French Pharmacovigilance Database.Therapie 2010; 65:255-259.
- Dooley M, et al. Donepezil: a review of its use in Alzheimer’s disease.Drugs Aging 2000; 16:199-226.
- Scott LJ, et al. Galantamine: a review of its use in Alzheimer’s disease.Drugs 2000; 60:1095-1122.
- Grossberg GT, et al. Lack of adverse pharmacodynamic drug interactions with rivastigmine and twenty-two classes of medications.Int JGeriatr Psychiatry 2000; 15:242-247.
- Tavassoli N, et al. Drug interactions with cholinesterase inhibitors: an analysis of the French pharmacovigilance database and a comparison of two national drug formularies (Vidal, British National Formulary).Drug Saf 2007; 30:1063-1071.
- Noetzli M, et al. Pharmacodynamic, pharmacokinetic and pharmacogenetic aspects of drugs used in the treatment of Alzheimer’s disease.Clin Pharmacokinet 2013; 52:225-241.
- Pasqualetti G, et al. Potential drug-drug interactions in Alzheimer patients with behavioral symptoms.Clin Interv Aging 2015; 10:1457-1466.
- Howard R, et al. Donepezil and memantine for moderate-to-severe Alzheimer’s disease.N Engl J Med 2012; 366:893-903.
- Howard R, et al. Nursing home placement in the Donepezil and Memantine in Moderate to Severe Alzheimer’s Disease (DOMINO-AD) trial: secondary and post-hoc analyses.Lancet Neurol 2015; 14:1171-1181.
- Medicines Complete. Stockley’s drug interactions. 2020; https://www.medicinescomplete.com.
- Truven Health Analytics. Micromedex 2.0. 2017; https://www.micromedexsolutions.com/home/dispatch.
- Di Santo SG, et al. A meta-analysis of the efficacy of donepezil, rivastigmine, galantamine, and memantine in relation to severity of Alzheimer’s disease.J Alzheimers Dis 2013; 35:349-361.
- Parsons C. Withdrawal of antidementia drugs in older people: who, when and how?Drugs Aging 2016; 33:545-556.
- National Institute for Health and Clinical Excellence. Dementia: assessment, management and support for people living with dementia and their carers. NICE Guideline [NG97]. 2018; https://www.nice.org.uk/guidance/ng97.
- National Institute for Health and Clinical Excellence. Donepezil, galantamine, rivastigmine and memantine for the treatment of Alzheimer’s disease. Technology Appraisal Guidance TA217. 2011 (last updated June 2018); https://www.nice.org.uk/Guidance/TA217.
- National Institute for Health and Clinical Excellence. Medicines optimisation: the safe and effective use of medicines to enable the best possible outcomes. National Guidance [NG5]. 2015 (last checked March 2019); https://www.nice.org.uk/guidance/ng5.
- Birks J, et al. Ginkgo biloba for cognitive impairment and dementia.Cochrane Database Syst Rev 2009; CD003120.
- Yuan Q, et al. Effects of Ginkgo biloba on dementia: an overview of systematic reviews.J Ethnopharmacol 2017; 195:1-9.
- Bent S, et al. Spontaneous bleeding associated with ginkgo biloba: a case report and systematic review of the literature: a case report and systematic review of the literature. J Gen Intern Med 2005; 20:657-661.
- Farina N, et al. Vitamin E for Alzheimer’s dementia and mild cognitive impairment.Cochrane Database Syst Rev 2017; 1:Cd002854.
- Dysken MW, et al. Effect of vitamin E and memantine on functional decline in Alzheimer disease: the TEAM-AD VA cooperative randomized trial.JAMA 2014; 311:33-44.
- Joe E, et al. Cognitive symptoms of Alzheimer’s disease: clinical management and prevention.BMJ 2019; 367:l6217.
- Malouf R, et al. Folic acid with or without vitamin B12 for the prevention and treatment of healthy elderly and demented people.Cochrane Database Syst Rev 2008; CD004514.
- Enderami A, et al. The effects and potential mechanisms of folic acid on cognitive function: a comprehensive review.Neurol Sci 2018; 39:1667-1675.
- Zhang DM, et al. Efficacy of Vitamin B supplementation on cognition in elderly patients with cognitive-related diseases.J Geriatr Psychiatry Neurol 2017; 30:50-59.
- Burckhardt M, et al. Omega-3 fatty acids for the treatment of dementia.Cochrane Database Syst Rev 2016; 4:Cd009002.
- Lee ST, et al. Panax ginseng enhances cognitive performance in Alzheimer disease.Alzheimer Dis Assoc Disord 2008; 22:222-226.
- Wang Y, et al. Ginseng for Alzheimer’s disease: a systematic review and meta-analysis of randomized controlled trials.Curr Top Med Chem 2016; 16:529-536.
- Doody RS, et al. Effect of dimebon on cognition, activities of daily living, behaviour, and global function in patients with mild-to-moderate Alzheimer’s disease: a randomised, double-blind, placebo-controlled study.Lancet 2008; 372:207-215.
- Chau S, et al. Latrepirdine for Alzheimer’s disease (Dimebon).Cochrane Database Syst Rev 2015; Cd009524.
- Li DQ, et al. Donepezil combined with natural hirudin improves the clinical symptoms of patients with mild-to-moderate Alzheimer’s disease: a 20-week open-label pilot study.Int J Med Sci 2012; 9:248-255.
- Wang BS, et al. Efficacy and safety of natural acetylcholinesterase inhibitor huperzine A in the treatment of Alzheimer’s disease: an updated meta-analysis.J Neural Transm 2009; 116:457-465.
- Yang G, et al. Huperzine A for Alzheimer’s disease: a systematic review and meta-analysis of randomized clinical trials.PLoS One 2013; 8:e74916.
- Hao Z, et al. Huperzine A for vascular dementia.Cochrane Database Syst Rev 2009; CD007365.
- Yue J, et al. Huperzine A for mild cognitive impairment.Cochrane Database Syst Rev 2012; 12:CD008827.
- Cui CC, et al. The effect of anti-dementia drugs on Alzheimer disease-induced cognitive impairment: a network meta-analysis.Medicine (Baltimore) 2019; 98:e16091.
- Ayati Z, et al. Saffron for mild cognitive impairment and dementia: a systematic review and meta-analysis of randomised clinical trials.BMC Complement Med Ther 2020; 20:333.
- Gavrilova SI, et al. Cerebrolysin in the therapy of mild cognitive impairment and dementia due to Alzheimer’s disease: 30 years of clinical use. Med Res Rev 2020. [Epub ahead of print].
- Cui S, et al. Cerebrolysin for vascular dementia.Cochrane Database Syst Rev 2019: CD008900
- McGuinness B, et al. Cochrane review on ‘Statins for the treatment of dementia’.Int J Geriatr Psychiatry 2013; 28:119-126.
- McGuinness B, et al. Statins for the prevention of dementia.Cochrane Database Syst Rev 2016: Cd003160.
- Chu CS, et al. Use of statins and the risk of dementia and mild cognitive impairment: A systematic review and meta-analysis.Sci Rep 2018; 8:5804.
- Poly TN, et al. Association between use of statin and risk of dementia: a meta-analysis of observational studies.Neuroepidemiology 2020;54:214-226.
- Moreira A, et al. Chocolate consumption is associated with a lower risk of cognitive decline.J Alzheimers Dis 2016; 53:85-93.
- Galimberti D, et al. Idalopirdine as a treatment for Alzheimer’s disease.Exp Opinion Invest Drugs 2015; 24:981-987.
- Matsunaga S, et al. Efficacy and safety of idalopirdine for Alzheimer’s disease: a systematic review and meta-analysis.Int Psychogeriatr 2019; 31:1627-1633.
- Jordan F, et al. Aspirin and other non-steroidal anti-inflammatory drugs for the prevention of dementia.Cochrane Database Syst Rev 2020; 4:Cd011459
- La AL, et al. Long-term trazodone use and cognition: a potential therapeutic role for slow-wave sleep enhancers.J Alzheimers Dis 2019;67:911-921.
- Halliday M, et al. Repurposed drugs targeting eIF2alpha-P-mediated translational repression prevent neurodegeneration in mice.Brain 2017; 140:1768-1783.
- Coupland C, et al. Antidepressant use and risk of adverse outcomes in older people: population based cohort study.BMJ 2011; 343:d4551.
- Doody RS, et al. A phase 3 trial of semagacestat for treatment of Alzheimer’s disease.N Engl J Med 2013; 369:341-350.
- Briggs R, et al. Drug treatments in Alzheimer’s disease.Clin Med (Lond) 2016; 16:247-253.
- Doody RS, et al. Phase 3 trials of solanezumab for mild-to-moderate Alzheimer’s disease.N Engl J Med 2014; 370:311-321.
- Honig LS, et al. Trial of solanezumab for mild dementia due to Alzheimer’s disease.N Engl J Med 2018; 378:321-330.
- Salloway S, et al. Two phase 3 trials of bapineuzumab in mild-to-moderate Alzheimer’s disease.N Engl J Med 2014; 370:322-333.
- Abushouk AI, et al. Bapineuzumab for mild to moderate Alzheimer’s disease: a meta-analysis of randomized controlled trials.BMC Neurol 2017; 17:66.
- Schneider L. A resurrection of aducanumab for Alzheimer’s disease.Lancet Neurol 2020; 19:111-112.
- Vaz M, et al. Alzheimer’s disease: recent treatment strategies.Eur J Pharmacol 2020; 887:173554.
- Kavirajan H, et al. Efficacy and adverse effects of cholinesterase inhibitors and memantine in vascular dementia: a meta-analysis of randomised controlled trials.Lancet Neurol 2007; 6:782-792.
- Wang J, et al. Cholinergic deficiency involved in vascular dementia: possible mechanism and strategy of treatment.Acta Pharmacol Sin 2009; 30:879-888.
- Bocti C, et al. Management of dementia with a cerebrovascular component.Alzheimer’s Dementia 2007; 3:398-403.
- Demaerschalk BM, et al. Treatment of vascular dementia and vascular cognitive impairment.Neurologist 2007; 13:37-41.
- Baskys A, et al. Pharmacological prevention and treatment of vascular dementia: approaches and perspectives.Exp Gerontol 2012; 47:887-891.
- Malouf R, et al. Donepezil for vascular cognitive impairment.Cochrane Database Syst Rev 2004; CD004395.
- Birks J. Cholinesterase inhibitors for Alzheimer’s disease.Cochrane Database Syst Rev 2006; CD005593.
- Craig D, et al. Galantamine for vascular cognitive impairment.Cochrane Database Syst Rev 2006; CD004746.
- Birks J, et al. Rivastigmine for vascular cognitive impairment.Cochrane Database Syst Rev 2013; 5:CD004744.
- Jin BR, et al. Comparative efficacy and safety of cognitive enhancers for treating vascular cognitive impairment: systematic review and Bayesian network meta-analysis.Neural Regen Res 2019; 14:805-816.
- Wild R, et al. Cholinesterase inhibitors for dementia with Lewy bodies.Cochrane Database Syst Rev 2003; CD003672.
- McKeith IG, et al. Diagnosis and management of dementia with Lewy bodies: fourth consensus report of the DLB consortium.Neurology 2017; 89:88-100.
- Taylor JP, et al. New evidence on the management of Lewy body dementia.Lancet Neurol 2020; 19:157-169.
- Newcastle University. Management of Lewy body dementia summary sheet Diamond Lewy. 2019; https://research.ncl.ac.uk/media/sites/researchwebsites/diamond-lewy/One%20page%20symptom%20LBD%20management%20summaries.pdf.
- Russ TC, et al. Cholinesterase inhibitors for mild cognitive impairment.Cochrane Database Syst Rev 2012; 9:CD009132.
- Cooper C, et al. Treatment for mild cognitive impairment: systematic review.Br J Psychiatry 2013; 203:255-264.
- Matsunaga S, et al. Efficacy and safety of cholinesterase inhibitors for mild cognitive impairment: asystematic review and meta-analysis.J Alzheimers Dis 2019; 71:513-523.
- Kasper S, et al. Management of mild cognitive impairment (MCI): the need for national and international guidelines.World J Biol Psychiatry 2020; 21:579-594.
- Nardell M, et al. Pharmacological treatments for frontotemporal dementias: a systematic review of randomized controlled trials.Am J Alzheimers Dis Other Demen 2014; 29:123-132.
- Li Y, et al. Cholinesterase inhibitors for rarer dementias associated with neurological conditions.Cochrane Database Syst Rev 2015; Cd009444.

