クロザピン,好中球減少およびリチウム
クロザピン誘発性好中球減少および無顆粒球症のリスク
好中球減少はクロザピンの投与を受けている患者の約2.7%に生じる。このうち半数は治療開始後18週間以内,3/4は治療開始後1年以内に発症する1。危険因子としては,アフリカ系カリブ人種,若年者,ベースラインの白血球数(WCC)が少ないことが挙げられる1。好中球減少のリスクは用量に関連しない。クロザピンによる好中球減少/無顆粒球症の発症機序は明らかではないが,免疫介在性の作用と直接的な細胞毒性の関与が重要であると考えられ,個人によって,また骨髄抑制の重症度によっても異なる可能性がある2。好中球減少または無顆粒球症のためにクロザピンを中止した後に再開すると,1/3の患者で血液障害が生じる。発端となる血液障害が無顆粒球症であった場合,2回目の反応は不可避であり,例外なく初回より早く生じ,より重症で長期間持続する3。発端となる血液障害が好中球減少であった場合には必ずしもそうはならない4。
クロザピンを服用中の患者では様々な理由で好中球数が減少するため,混乱が生じる。好中球減少が1回起きただけでは,すべての薬剤でよくみられる好中球減少と同様に,臨床的な重要性のない偶発的所見である可能性がある。良性人種性好中球減少症(BEN,後述)やクロザピンに関連する骨髄抑制(特に連続的かつ進行性に減少する場合)の結果として,好中球減少が(連続的または間欠的に)数回発生することがある。本格的な無顆粒球症はおそらく常にクロザピンによる重度の骨髄抑制が原因と解釈でき,その経過が重要と考えられる。BENでない患者における無顆粒球症では,好中球数正常の後に好中球数が急に(通常は1週間以内に)減少し5, 6,(治療を行わなかったと仮定して)好中球数がゼロに近い期間が長く続く。
この特徴的なパターンに従わない好中球数は解釈が難しい。アイスランドの研究では,クロザピンとクロザピン以外の抗精神病薬における重度好中球減少症リスクに差は認められず,クロザピン投与中の好中球減少例の多くはクロザピンが原因ではない可能性が示唆された7。実際,クロザピンとその他の抗精神病薬の好中球減少のリスクを比較したメタ解析では,クロザピンの好中球減少との関連は他の抗精神病薬と比べて強いわけではなかった8。
クロザピンによる治療中の無顆粒球症の有病率はこれまで考えられていたよりも低く(0.4%)9,無顆粒球症による死亡のリスクは0.05%であり,稀な事象といえる。無顆粒球症の80%以上は治療開始から18週間以内に生じる1。Netherlands Clozapine Collaboration Group10は,無顆粒球症のリスクは非常に低いため,十分な理解能力がある患者では治療開始後6ヵ月でルーチンの血液学的モニタリングを中止してもよいと考えている。同グループはそれでもやはり,ルーチンのモニタリングを中止する場合は例えば年4回のような低頻度の検査を行うことを推奨している。
無顆粒球症の危険因子は高齢,アジア系人種である1。遺伝的素因も関与すると考えられる11。無顆粒球症と好中球減少/偶発的な低好中球数では発症時期および危険因子は異なるが,好中球減少が無顆粒球症の前段階ではないと言い切ることは難しい。
血液学的リスクを軽減するため,血液学的モニタリングが義務化されている。しかし,世界的に,クロザピン中断のためのモニタリング頻度と閾値に関する推奨には大きなばらつきがあり12,これはおそらく,根拠とするエビデンスが弱いためと考えられる。2015年10月に,米国食品医薬品局(FDA)はクロザピンのモニタリングシステムに変更を加え,好中球絶対数(ANC)のみを必須とし,クロザピン投与中断の判断基準を実質的に緩和させた13。クロザピンによる治療は,好中球数が1,000/mm3未満に減少したら中止することが推奨されている(対して英国では,ANCが1,500/mm3未満になったら中止することを推奨している)。FDAの新たな規制は米国におけるクロザピン使用を間違いなく促進し,国際的にも意義をもつだろう。
クロザピンは世界的に十分利用されていないことを示すエビデンスがあり,各国間の処方頻度には非常にばらつきがある14。これは,少なくとも部分的には,厳格な血液モニタリング要件により説明できると考えられる。2020年に起きたCOVID-19の世界的大流行をきっかけに,クロザピンの血液学的モニタリングが再評価され,あるグループは,クロザピンを1年以上投与され,好中球減少の既往がない患者において,モニタリングを毎月から3ヵ月に1回に減らすことを提唱した15。無顆粒球症は1週間以内で発症することを考えると,特に無顆粒球症の全体的なリスクがほぼゼロである患者では,毎月のモニタリングの意義は明らかに疑わしい。
良性人種性好中球減少症
良性人種性好中球減少症(BEN)は,好中球数が比較的少なくなることを特徴とする,広く認められる遺伝性疾患である。アフリカ系や中東系の人々の有病率が高い。BENは低白血球数(WCC)を特徴とし,WCCがしばしば正常下限値未満に低下することがある。このパターンはクロザピンの開始前,投与中,投与後にかかわらず観察されることがある。おそらく,観察される,または見かけ上のクロザピン関連好中球減少の一部はBENであると考えられ,投与中止の要因の1つにもなる。多くの国では,BENの状態を登録することで,これらの患者における好中球数の下限を低く設定することが可能である。BENが背景にありながら,真のクロザピン誘発性好中球減少が起こる場合もあるが,現在のエビデンスでは,クロザピン投与中のBENは血液障害リスクの増加を起こさないことが示唆されている16, 17。
併用薬
血液学的副作用と関連する様々な種類の薬剤がクロザピンと同時に処方される。これらの併用薬としては,他の抗精神病薬,バルプロ酸ナトリウムおよびカルバマゼピン等の抗けいれん薬,抗菌薬,プロトンポンプ阻害薬等の胃腸薬がある。クロザピン投与中に好中球減少が生じる患者は多いが,すべてがクロザピンに関連したものではなく,病的でないこともある。これらの併用薬の寄与を常に考慮し,クロザピンの再投与を試みる場合はこれらの併用薬を中止すべきである18。
管理の選択肢
投与を開始する前に,ベースラインの血液検査値を評価することが重要である。BENであることが疑われる場合,確認のため血液専門医に紹介すべきである19。
真のクロザピン毒性とクロザピンに関連しない好中球減少を確信をもって鑑別することは不可能であるが,いくつかの因子が重要である。BENの確定診断を行い,また原因となる可能性のある他の併用薬を除外するために,血液専門医による診察が勧められる。クロザピン誘発性好中球減少の既往が明らかな場合(クロザピンが原因であることが確実な場合)には,WCCを増加させる目的で薬剤を投与することは推奨されない。リチウム等の薬剤は,過去の好中球減少のエピソードがクロザピンとは関連がないと強く考えられる場合にのみ使用すべきである。過去にクロザピン誘発性無顆粒球症があった場合は,クロザピンを再開すべきではない。
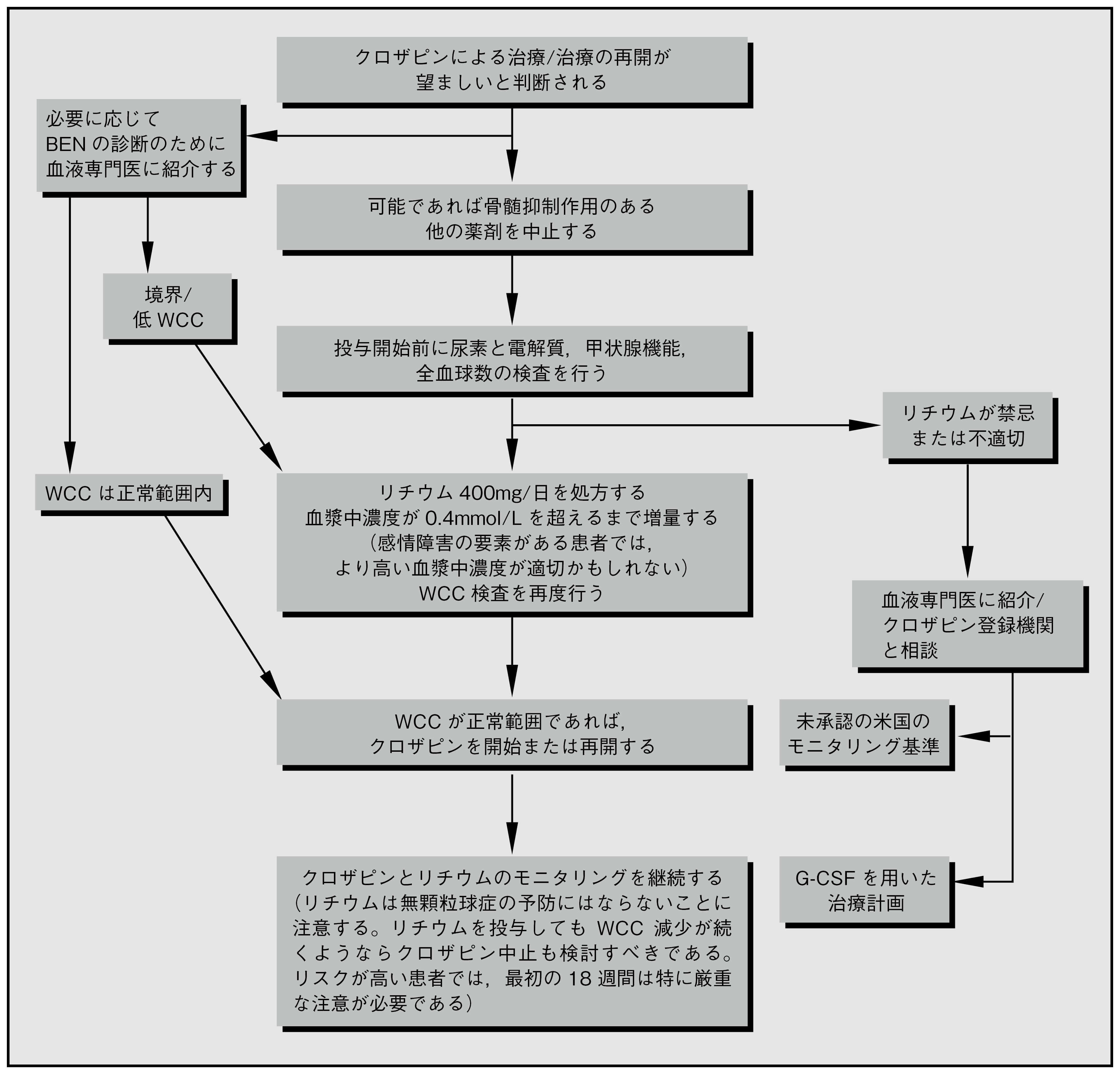
リチウム
リチウムは好中球数と総WCCの両者を急性的かつ慢性的に増加させる。この効果の程度は十分には定量化されていないが,リチウムの投与を受けている患者では好中球数が平均11.9×109/Lになったという報告や,クロザピン投与中の患者にリチウムを追加すると好中球数が平均2×109/L増加したという報告がある。この効果は明確な用量依存性を示さないようであるが,血清リチウム濃度は少なくとも0.4mmol/Lは必要かもしれない。機序は完全には解明されていない20。
これまでにもクロザピン投与中に好中球減少が生じた患者にWCCを増加させる目的でリチウムが使用されており,そうするとクロザピンの継続が可能になる。成人21-25および小児26, 27の症例報告があり,これらのほぼすべての患者の血清リチウム濃度は0.6mmol/L を超えていた。血液障害が原因でクロザピンを中止し,リチウムを併用してクロザピンを再開した患者の症例集積研究(n=25)では,再開後に血液障害が再発した患者はわずか1例であった28。リチウムを検討する場合,特定の患者に対する最適な薬物療法を決定するため,関係するモニタリングサービスにおける医学アドバイザーと協議する。
リチウムが真のクロザピンによる無顆粒球症を防ぐことはないと考えられる。クロザピンとリチウムの併用による致死性無顆粒球症が1例報告されており25,2例目の無顆粒球症患者は,顆粒球コロニー刺激因子(G-CSF)による治療でも骨髄の反応が得られないことが報告された29。
図1.4 リチウムとクロザピンの併用
顆粒球コロニー刺激因子(G-CSF)
好中球減少の既往がある患者にG-CSFを投与し,クロザピン治療の継続を促す方法に注目が集まっているが,まだ議論がある。症例報告では,クロザピンを継続するために定期的かつ長期的にG-CSFを投与して奏効したという報告30-32と失敗したという報告32, 33がある。よくみられる副作用として,骨痛34,好中球形成不全35があり,好中球数が少ないか減少しつつある状態でG-CSFを投与すると,好中球減少や無顆粒球症が隠されてしまい,重大な結果を招く可能性がある。G-CSF投与の長期的な安全性は確立されておらず,骨密度と脾臓の大きさをモニタリングすべきであろう。
「必要に応じて」(好中球が規定の閾値未満になったとき)G-CSFを投与すれば,リチウムではWCCの正常範囲未満への低下を防げなかった患者でクロザピンが再開できる可能性がある。この方法でも重度の好中球減少や無顆粒球症が隠されるリスクがある。また,この方法では頻回の血液検査(1週間に2,3回)が必要であり,診察とG-CSFの投与を受けるための来院回数も多いので,専門の施設以外での管理は現実的に難しいと思われる。
G-CSFの使用を考慮する前に,血液専門医との相談およびクロザピンモニタリングサービスの医学アドバイザーとの協議が必須である。個々の患者で臨床的状況を考慮する。特に初回の血液障害で以下のような点がみられた場合には,クロザピンの再投与に対するリスクは非常に高いとみなすべきである。以下はすべて,好中球減少がクロザピンに関連することを示唆している。
- 以前のWCCと一貫性がない場合(すなわち,普段から持続しているWCC減少のパターンとは異なる場合)
- 治療を開始してから18週間以内に起こった場合
- 重度の場合(好中球数0.5×109/L未満)
- 長期間持続している場合
G-CSFは,クロザピンによる好中球減少のエピソードが認められる患者においてクロザピンの再投与を成功させることが報告されているが36,得られているエビデンスに基づくと,真のクロザピンによる無顆粒球症の患者についてはこの措置は除外される37。
以下に該当する場合の管理に使用する。
- 最初からWCCが少ない(4×109/L未満),または好中球数が少ない(2.5×109/L未満)場合
- 白血球減少(3×109/L未満)もしくは好中球減少(1.5×109/L未満)であっても,良性人種性好中球減少症(BEN)と考えられる場合。このような患者はアフリカ系か中東系で,易感染性の既往がなく,白血球は形態学的に正常である可能性が高い38
- クロザピンによる治療中に繰り返し「黄信号」の結果がみられる場合
- クロザピンとは関連しないと考えられる「赤信号」の結果がみられる場合
<編集協力者コメント>
本邦では2021年6月より血液モニタリングが,52週以降,条件付きで4週間隔の検査とすることが可能となった。再投与検討基準や好中球減少症の既往歴のある患者に関する基準にも変更があった( https://www.jspn.or.jp/modules/info/index.php?content_id=880 )。
(岩田 祐輔)
参照文献
- Munro J, et al. Active monitoring of 12760 clozapine recipients in the UK and Ireland. Br J Psychiatry 1999; 175:576–580.
- Whiskey E, et al. Restarting clozapine after neutropenia: evaluating the possibilities and practicalities. CNS Drugs 2007; 21:25–35.
- Dunk LR, et al. Rechallenge with clozapine following leucopenia or neutropenia during previous therapy. Br J Psychiatry 2006; 188:255–263.
- Prokopez CR, et al. Clozapine rechallenge after neutropenia or leucopenia. J Clin Psychopharmacol 2016; 36:377–380.
- Almaghrebi AH. Safety of a clozapine trial following quetiapine-induced leukopenia: a case report. Curr Drug Saf 2019; 14:80–83.
- Patel NC, et al. Sudden late onset of clozapine-induced agranulocytosis. Ann Pharmacother 2002; 36:1012–1015.
- Ingimarsson O, et al. Neutropenia and agranulocytosis during treatment of schizophrenia with clozapine versus other antipsychotics: an observational study in Iceland. BMC Psychiatry 2016; 16:441.
- Myles N, et al. A meta-analysis of controlled studies comparing the association between clozapine and other antipsychotic medications and the development of neutropenia. Aust N Z J Psychiatry 2019; 53:403–412.
- Li XH, et al. The prevalence of agranulocytosis and related death in clozapine-treated patients: a comprehensive meta-analysis of observational studies. Psychol Med 2020; 50:583–594.
- Netherlands Clozapine Collaboration Group. Guideline for the use of Clozapine version 05-02-2013. 2013; https://www.clozapinepluswerkgroep.nl/wp-content/uploads/2013/07/Guideline-for-the-use-of-Clozapine-2013.pdf .
- Dettling M, et al. Further evidence of human leukocyte antigen-encoded susceptibility to clozapine-induced agranulocytosis independent of ancestry. Pharmacogenetics 2001; 11:135–141.
- Nielsen J, et al. Worldwide differences in regulations of clozapine use. CNS Drugs 2016; 30:149–161.
- FDA. FDA Drug Safety Communication: FDA modifies monitoring for neutropenia associated with schizophrenia medicine clozapine; approves new shared REMS program for all clozapine medicines. 2016; https://www.fda.gov/Drugs/DrugSafety/ucm461853.htm .
- Bachmann CJ, et al. International trends in clozapine use: a study in 17 countries. Acta Psychiatr Scand 2017; 136:37–51.
- Siskind D, et al. Consensus statement on the use of clozapine during the COVID-19 pandemic. J Psychiatry Neurosci 2020; 45:222–223.
- Manu P, et al. Benign ethnic neutropenia and clozapine use: a systematic review of the evidence and treatment recommendations. J Clin Psychiatry 2016; 77:e909–916.
- Richardson CM, et al. Evaluation of the safety of clozapine use in patients with benign neutropenia. J Clin Psychiatry 2016; 77:e1454–e1459.
- Shuman MD, et al. Exploring the potential effect of polypharmacy on the hematologic profiles of clozapine patients. J Psychiatr Pract 2014; 20:50–58.
- Whiskey E, et al. The importance of the recognition of benign ethnic neutropenia in black patients during treatment with clozapine: case reports and database study. J Psychopharmacology 2011; 25:842–845.
- Paton C, et al. Managing clozapine-induced neutropenia with lithium. Psychiatric Bull 2005; 29:186–188.
- Adityanjee A. Modification of clozapine-induced leukopenia and neutropenia with lithium carbonate. Am J Psychiatry 1995; 152:648–649.
- Silverstone PH. Prevention of clozapine-induced neutropenia by pretreatment with lithium. J Clin Psychopharmacol 1998; 18:86–88.
- Boshes RA, et al. Initiation of clozapine therapy in a patient with preexisting leukopenia: a discussion of the rationale of current treatment options. Ann Clin Psychiatry 2001; 13:233–237.
- Papetti F, et al. Treatment of clozapine-induced granulocytopenia with lithium (two observations). Encephale 2004; 30:578–582.
- Kutscher EC, et al. Clozapine-induced leukopenia successfully treated with lithium. Am J Health Syst Pharm 2007; 64:2027–2031.
- Sporn A, et al. Clozapine-induced neutropenia in children: management with lithium carbonate. J Child Adolesc Psychopharmacol 2003; 13:401–404.
- Mattai A, et al. Adjunctive use of lithium carbonate for the management of neutropenia in clozapine-treated children. Human Psychopharmacology 2009; 24:584–589.
- Kanaan RA, et al. Lithium and clozapine rechallenge: a restrospective case analysis. J Clin Psychiatry 2006; 67:756–760.
- Valevski A, et al. Clozapine-lithium combined treatment and agranulocytosis. Int Clin Psychopharmacol 1993; 8:63–65.
- Spencer BW, et al. Granulocyte colony stimulating factor (G-CSF) can allow treatment with clozapine in a patient with severe benign ethnic neutropaenia (BEN): a case report. J Psychopharmacol 2012; 26:1280–1282.
- Hagg S, et al. Long-term combination treatment with clozapine and filgrastim in patients with clozapine-induced agranulocytosis. Int Clin Psychopharmacol 2003; 18:173–174.
- Joffe G, et al. Add-on filgrastim during clozapine rechallenge in patients with a history of clozapine-related granulocytopenia/agranulocytosis. Am J Psychiatry 2009; 166:236.
- Mathewson KA, et al. Clozapine and granulocyte colony-stimulating factor: potential for long-term combination treatment for clozapine-induced neutropenia. J Clin Psychopharmacol 2007; 27:714–715.
- Puhalla S, et al. Hematopoietic growth factors: personalization of risks and benefits. Mol Oncol 2012; 6:237–241.
- Bain BJ, et al. Neutrophil dysplasia induced by granulocyte colony-stimulating factor. Am J Hematol 2010; 85:354.
- Myles N, et al. Use of granulocyte-colony stimulating factor to prevent recurrent clozapine-induced neutropenia on drug rechallenge: a systematic review of the literature and clinical recommendations. Aust N Z J Psychiatry 2017; 4867417720516.
- Lally J, et al. The use of granulocyte colony-stimulating factor in clozapine rechallenge: a systematic review. J Clin Psychopharmacol 2017; 37:600–604.
- Hsieh MM, et al. Prevalence of neutropenia in the U.S. population: age, sex, smoking status, and ethnic differences. Ann Intern Med 2007; 146:486–492.

