抗精神病薬の中止
抗精神病薬は,症状を軽減し,再発リスクを低下できることから,統合失調症の長期治療に推奨されている1。しかし,抗精神病薬には代謝性合併症,遅発性ジスキネジア,感情の鈍麻,脳の萎縮等の多くの副作用がある2。患者の抗精神病薬を減らす,または中止すると,短期的には再発のリスクを高めるかもしれないが4,中期的には再発率や症状負荷を悪化することなく3,社会的機能(人間関係,教育または雇用,自立した生活)が改善する可能性があるといういくつかのエビデンスがある。抗精神病薬の負荷を減らすことで認知機能が向上する可能性があるというエビデンスもある5。
さらに,抗精神病薬の再発予防効果に関するエビデンスは中止試験に頼っているが,これらの試験では抗精神病薬は大部分が1日で中止されたために退薬症状が生じ,中止群で見かけの再発率が上昇し,抗精神病薬の再発予防効果が誇張された可能性がある6。患者は薬剤の減量または中止を希望することが多く,上記の点を踏まえると,減量・中止は妥当な行動方針であると考えられる。慎重な脱処方(de-prescribing)を,質の高い処方実践の一要素とすべきである。
さらに注意が必要であることとして,英国における抗精神病薬処方の半分以上は精神病性障害または躁病のない患者に行われており,不眠,不安,パーソナリティ障害,認知症の諸症状に対して処方されているが7,NICEはパーソナリティ障害に対する抗精神病薬の中期または長期使用を推奨しておらず8,認知症に対してのみ慎重な使用を推奨している9。以下に概要を示した脱処方の原則は,これらの患者にも適用される。
抗精神病薬の離脱/退薬症状
抗精神病薬の中止または減量により,抗精神病薬の種々の作用(ドパミン受容体,ヒスタミン受容体,アセチルコリン受容体,セロトニン受容体,ノルアドレナリン受容体の遮断)を反映した様々な症状が発現する可能性がある10, 11。自律神経症状(下痢,流涎,発汗),身体症状(頭痛,悪心,嘔吐,食欲不振),運動症状(ふるえ,不穏,ジスキネジア),心理症状(不安,被刺激性,激越,不眠,精神病症状)等がみられる(図1.1)10, 11。不眠はおそらく最も頻度の高い離脱症状である。
図1.1 抗精神病薬の離脱症状 出典:Chouinardら(2017)11
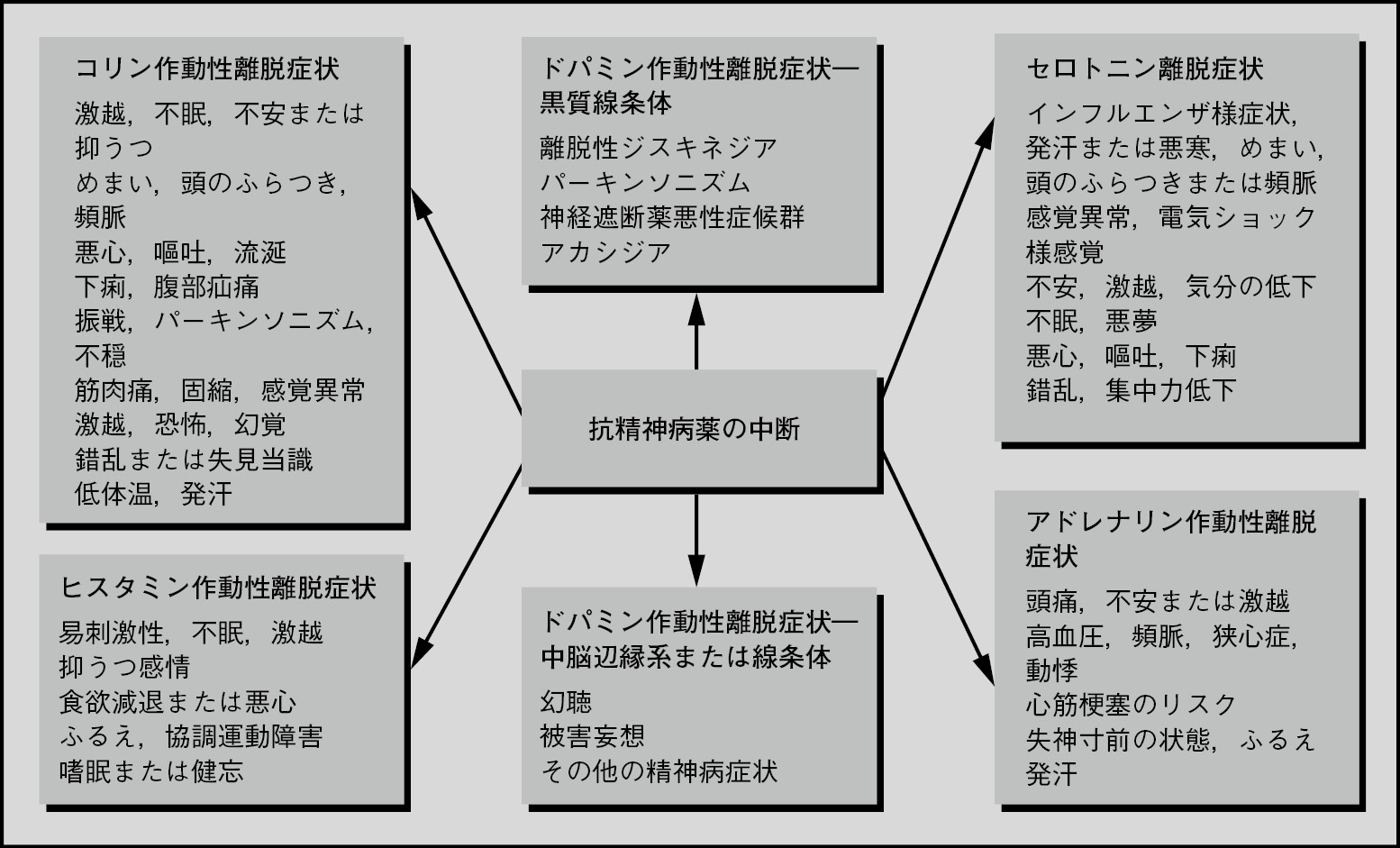
重要な点として,抗精神病薬の離脱/退薬症状に精神病症状が含まれる場合がある11, 12。このことは,いくつかの症例研究において,悪心または授乳困難等の理由でドパミン拮抗薬を使用した,精神病性障害のない患者で,これらの薬剤を突然中止すると精神病症状が発現することから示唆されている13-15。
精神病性障害の患者では,抗精神病薬を中断すると再発が起こる場合が多い。これは,基礎にある慢性疾患の露見であると広く考えられているが,抗精神病薬中断の過程の性質そのものが,原因として再発に関連する可能性がある6。これは,治療中止試験において,統合失調症患者では抗精神病薬を突然中止した直後の再発が顕著に多いことによって裏付けられる。ある解析では,4年間に起きた再発全体の60%が薬剤の中止後3ヵ月以内に発生しており16,この期間は離脱症状が明らかになる可能性が最も高い。また,緩やかな減量により再発率を低下させることができるというエビデンスによっても支持される16。
離脱の神経生物学
離脱に関連した再発は,長期の抗精神病薬投与に対する神経順応(ドパミン過感受性)が,抗精神病薬中止後も持続することに起因している17。実際に,統合失調症における分子イメージングを用いた研究では,D2/D3受容体アベイラビリティが,抗精神病薬を使用していた患者では増加しているが,抗精神病薬未投与の患者では増加していないことが明らかになった18。このドパミンに対する過感受性によって,患者は,抗精神病薬減量によりD2遮断が低下したときに精神病再発をきたしやすくなると考えられる10, 17。
抗精神病薬使用中の神経順応作用は,中止後数ヵ月から数年間持続する可能性があることを示唆するエビデンスが集まっている。動物でのドパミン過感受性は,治療の中止後,ヒトでの1年に相当する期間持続する19, 20。ドパミン過感受性に起因する遅発性ジスキネジアは,抗精神病薬の中止後数年間持続する可能性がある21。抗精神病薬を中止した患者は,継続した患者と比較して,3年間は再発率が高いが,その後再発率は収束するというエビデンスもあり1,この時点までに順応が消失する可能性が示唆される。
したがって,抗精神病薬の中止による再発リスクは,より緩やかに用量を漸減することによって最小限に抑えられる可能性があるということになる。そうすれば漸減過程でこれらの神経順応が消失する時間ができ,遮断の低下率がより小さくなるためである。小規模の解析により,3-9ヵ月かけて漸減した場合には,突然中止した場合と比較して再発率が半減することが明らかになったが16,4週間での漸減では突然の中止との差は認められなかった1。
漸減のパターン
PETイメージングによって抗精神病薬用量とD2受容体占有率の間の双曲線関係が示されている22。この双曲線関係は,質量作用の法則(薬剤分子が追加される毎に受容体標的が飽和されて効果が徐々に低下すること)から生じるものであり,抗精神病薬の標的となるその他の受容体(ヒスタミン受容体,コリン受容体,セロトニン受容体等)にも同様に当てはまる23。この関係の性質は,用量反応曲線を片対数軸にプロットする慣習によって曖昧になる場合が多い23。抗精神病薬用量とその治療効果(症状尺度により評価)の間にも双曲線関係が示されており24,臨床反応は神経生物学的な作用のパターンを反映していることが示唆される。
このことから,例えばオランザピンの20mgから15mg,10mg,5mg,0mgへの減量のような,抗精神病薬用量の直線的な減量の根拠に疑問が生じる。このレジメンは合理的であるように思われるが,用量とD2遮断への作用との双曲線関係から,このような直線的な減量ではD2遮断の低下(そしてその臨床的帰結)が次第に大きくなることになる(図1.2A)。実際に,オランザピンを5mgから0mgに減量したときのD2遮断の低下(52.6%)は,40mgから5mgに減量したときの低下(37.3%)より大きくなる。このようにD2遮断の低下が次第に大きくなることによって,再発が起こる可能性が高まると考えられる。
D
図1.2
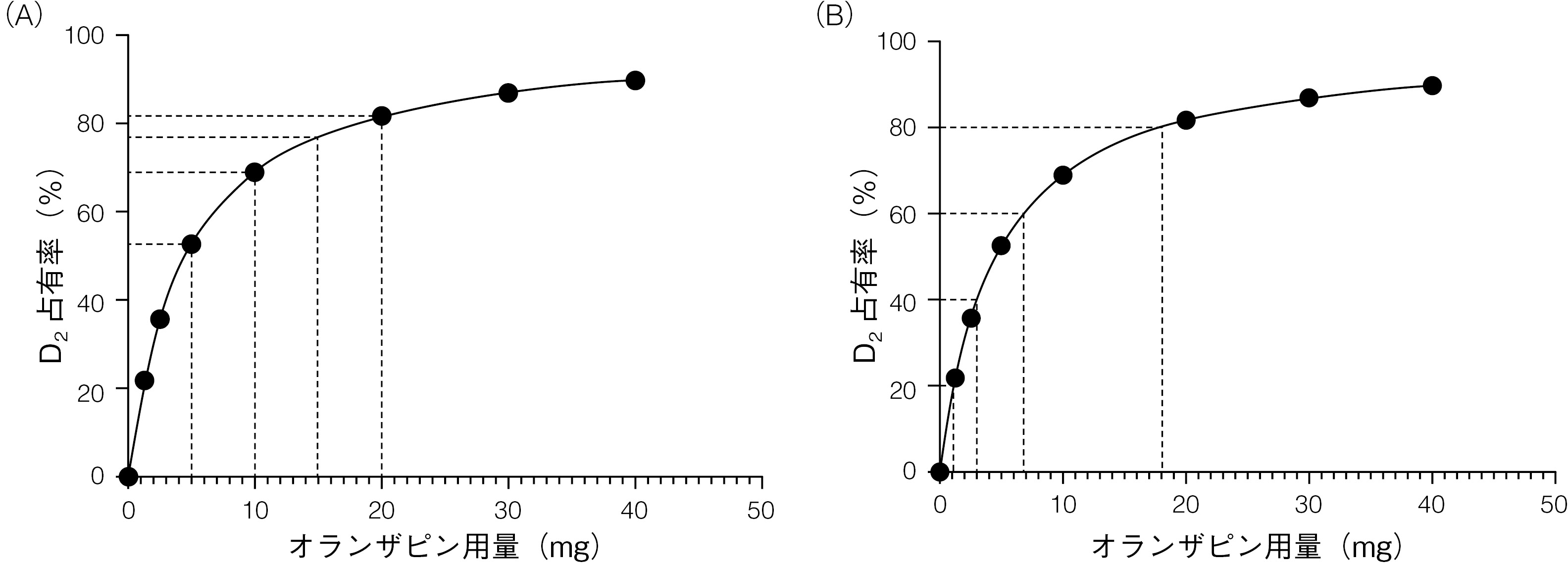
(A)リスペリドン用量を直線的に減量すると,D2ドパミン受容体遮断の低下幅が次第に大きくなる。リスペリドン用量とD2遮断の関係は,PET研究のメタ解析による最良適合線から導き出している22。
(B)D2ドパミン受容体占有率の直線的な低下(この場合20%毎の低下)と,これに対応するリスペリドンの双曲線的な減量。本図で対応する用量(D2占有率)は6.9mg(D2占有率80%),2.0mg(D2占有率60%),0.82mg(D2占有率40%),0.30mg(D2占有率20%)。
市販されている製剤に対応するこのレジメンに近い方法を本文中に示している。
指数関数的に減量するレジメン(すなわち,直近の用量から固定の割合で減量する方法)では,抗精神病薬のすべての受容体標的でほぼ直線的な低下が生じることから,この方法は幅広い抗精神病薬に適用できる。特に,一部の患者において再発を引き起こすことなく抗精神病薬を半分以上減量できた試験では,6ヵ月毎に直近の用量から25%減量する,指数関数的な減量方法を用いていた27。
実臨床における漸減
すべての患者に,抗精神病薬を中止または減量した場合の,不眠や精神病症状の増悪等の離脱症状のリスクを説明すべきである。クロザピンは強力な抗コリン作用を持つことがおそらく原因で,離脱症状を伴うことが最も多く,重症度も比較的に高い。
抗精神病薬の突然の中止は,再発および/または重度の離脱症状を誘発する可能性が最も高いと考えられる方法であるため,行ってはならないことを患者に警告する必要がある。
中止を試みる時期
長期のまたは生涯にわたる抗精神病薬投与はいかにも現代的である。1960年代には,抗精神病薬の中止を急性反応の後に試みるのが通常であったが,突然の中止により再発が生じることが多かった(ただし,興味深いことに,必ず起こるわけではなかった29)。現時点で抗精神病薬の中断に関するエビデンスに基づく推奨は存在しないが,6ヵ月間(初回エピソードの場合)または1年間(複数回エピソードの場合)寛解にある患者においてのみ試みることが推奨される。
初期の減量は,その患者のそれまでの減量経験から導き出すことが可能である。多くの患者では直近の用量から約25%減量することができるが(例:オランザピンの場合は20mgから15mgに減量),現在の用量の10%という小幅の減量が必要となる場合もある。減量後は3ヵ月間患者をモニタリングし,離脱症状や精神病症状の悪化がないかどうかを調べる必要がある。つまり,これらの症状は避けられない再発の徴候というよりも一過性の離脱症状である可能性について留意しつつ,また,これらの症状が通常用量の投与を再開する必要性を示しているのかもしれないことも考慮する。患者がこの減量を忍容でき,全般的な精神状態に顕著な影響は認められない(または軽度の不眠症状のようなもののみである)場合は,同じ速度でさらに減量を行うことができる(例:3ヵ月毎に10-25%減量)。この中断期間には患者にさらなる心理社会的サポートが必要と考えられる。
患者に著しい離脱症状または精神病症状の悪化が認められる場合は,増量して元の用量に(またはその途中まで)戻すことが必要と考えられる。これにより減量のさらなる試みが不可能になるわけではないが,安定が確認されるまで遅らせるべきであり,それまでより緩やかに(おそらく現在用量の5-10%ほどの小幅で)行わなければならないことに注意が必要である。
D2遮断の大幅な低下を防止するために,完全中止前の最終用量は極めて低用量にする必要がある。これは,元の治療用量のわずか1/80でなければならない場合もある(例:オランザピン0.25mg)。このような少量を送達するには,錠剤を割るか,液剤を使用することが必要となる。
減量レジメンの例を表1.11および表1.12に示す。
表1.11 各段階でD2占有率を5パーセントポイント低下させるオランザピン用量の減量
| 期間 | オランザピン用量(mg) | D2占有率(%) |
| 1 | 20 | 81.6 |
| 2 | 14 | 75 |
| 3 | 10.5 | 70 |
| 4 | 8.4 | 65 |
| 5 | 6.8 | 60 |
| 6 | 5.5 | 55 |
| 7 | 4.5 | 50 |
| 8 | 3.7 | 45 |
| 9 | 3 | 40 |
| 10 | 2.4 | 35 |
| 11 | 1.9 | 30 |
| 12 | 1.5 | 25 |
| 13 | 1.1 | 20 |
| 14 | 0.8 | 15 |
| 15 | 0.5 | 10 |
| 16 | 0.24 | 5 |
| 17 | 0 | 0 |
表1.12 各段階でD2占有率を2.5パーセントポイント低下させるオランザピン用量の減量。より大きな減量をD2占有率への作用が「等間隔」になるように行うには,このレジメンを2段階または3段階おきにして実行する。
| 期間 | オランザピン用量(mg) | D2占有率(%) |
| 1 | 20 | 81.6 |
| 2 | 15.5 | 77.5 |
| 3 | 13.5 | 75 |
| 4 | 11.9 | 72.5 |
| 5 | 10.5 | 70 |
| 6 | 9.3 | 67.5 |
| 7 | 8.4 | 65 |
| 8 | 7.5 | 62.5 |
| 9 | 6.8 | 60 |
| 10 | 6.1 | 57.5 |
| 11 | 5.5 | 55 |
| 12 | 5 | 52.5 |
| 13 | 4.5 | 50 |
| 14 | 4.1 | 47.5 |
| 15 | 3.7 | 45 |
| 16 | 3.3 | 42.5 |
| 17 | 3 | 40 |
| 18 | 2.7 | 37.5 |
| 19 | 2.4 | 35 |
| 20 | 2.2 | 32.5 |
| 21 | 1.9 | 30 |
| 22 | 1.7 | 27.5 |
| 23 | 1.5 | 25 |
| 24 | 1.3 | 22.5 |
| 25 | 1.1 | 20 |
| 26 | 0.95 | 17.5 |
| 27 | 0.8 | 15 |
| 28 | 0.65 | 12.5 |
| 29 | 0.5 | 10 |
| 30 | 0.37 | 7.5 |
| 31 | 0.24 | 5 |
| 32 | 0.1 | 2.5 |
| 33 | 0 | 0 |
表1.13 オランザピンで実施可能な減量スケジュールの要約
オランザピンを2-3ヵ月毎に5-10mgずつ20mg/日に達するまで減量する
続いて2-3ヵ月毎に2.5-5mgずつ10mg/日に達するまで減量する
続いて2-3ヵ月毎に1.25-2.5mgずつ5mg/日に達するまで減量する
続いて2-3ヵ月毎に0.6-1.25mgずつ2.5mg/日に達するまで減量する
続いて2-3ヵ月毎に0.3-0.6mgずつ1.25mg/日に達するまで減量する
続いて2-3ヵ月毎に0.15-0.3mgずつ0.6mg/日に達するまで減量する
続いて2-3ヵ月毎に0.07-0.15mgずつ減量して完全に中止する
この過程は,患者がどの程度減量を忍容できるかに応じて12-48ヵ月かけて実施すべきである
<編集協力者コメント>
- 図1.2に関する説明が,本文の前半およびグラフのX軸ではオランザピンで記載されているのに対し,本文の後半および図の説明文ではリスペリドンで記載されているため,混乱を招く可能性があるが,原文のままである。
- リスペリドンの用量とD2受容体占有率の双曲線関係は文献22,25に記載されており,オランザピンの用量とD2受容体占有率の双曲線関係は文献22に記載されているため,原著も参照するとよいかもしれない。
- 日本での保険適用の最大用量はオランザピン20mg/日,リスペリドン12mg/日までである。
(長井 信弘)
参照文献
- Leucht S, et al. Antipsychotic drugs versus placebo for relapse prevention in schizophrenia: a systematic review and meta-analysis. Lancet 2012; 379:2063–2071.
- Murray RM, et al. Should psychiatrists be more cautious about the long-term prophylactic use of antipsychotics? Br J Psychiatry 2016; 209:361–365.
- Wunderink L, et al. Recovery in remitted first-episode psychosis at 7 years of follow-up of an early dose reduction/discontinuation or maintenance treatment strategy: long-term follow-up of a 2-year randomized clinical trial. JAMA Psychiatry 2013; 70:913–920.
- Wunderink L, et al. Guided discontinuation versus maintenance treatment in remitted first-episode psychosis: relapse rates and functional outcome. J Clin Psychiatry 2007; 68:654–661.
- Omachi Y, et al. Dose reduction/discontinuation of antipsychotic drugs in psychosis; effect on cognition and functional outcomes. Frontiers in Psychiatry 2018; 9:447.
- Moncrieff J. Antipsychotic Maintenance. Treatment: time to rethink? PLoS Med 2015; 12:e1001861.
- Marston L, et al. Prescribing of antipsychotics in UK primary care: a cohort study. BMJ Open 2014; 4:e006135.
- National Institute for Clinical Excellence. Borderline personality disorder: recognition and management. Clinical Guidance 78 [CG78]. 2009 (Last checked July 2018); https://www.nice.org.uk/guidance/CG78 .
- National Institute for Health and Care Excellence. Dementia: assessment, management and support for people living with dementia and their carers [NG97]. 2018; https://www.nice.org.uk/guidance/ng97 .
- Cerovecki A, et al. Withdrawal symptoms and rebound syndromes associated with switching and discontinuing atypical antipsychotics: theoretical background and practical recommendations. CNS Drugs 2013; 27:545–572.
- Chouinard G, et al. Antipsychotic-induced dopamine supersensitivity psychosis: pharmacology, criteria, and therapy. Psychother Psychosom 2017; 86:189–219.
- Moncrieff J. Does antipsychotic withdrawal provoke psychosis? Review of the literature on rapid onset psychosis (supersensitivity psychosis) and withdrawal-related relapse. Acta Psychiatr Scand 2006; 114:3–13.
- Lu ML, et al. Metoclopramide-induced supersensitivity psychosis. Ann Pharmacother 2002; 36:1387–1390.
- Roy-Desruisseaux J, et al. Domperidone-induced tardive dyskinesia and withdrawal psychosis in an elderly woman with dementia. Ann Pharmacother 2011; 45:e51.
- Seeman P Breast is best but taper domperidone when stopping (e-letter). 2014; https://bjgp.org/content/yes-breast-best-taper-domperidone-when-stopping .
- Viguera AC, et al. Clinical risk following abrupt and gradual withdrawal of maintenance neuroleptic treatment. Arch Gen Psychiatry 1997; 54:49–55.
- Chouinard G, et al. Atypical antipsychotics: CATIE study, drug-induced movement disorder and resulting iatrogenic psychiatric-like symptoms, supersensitivity rebound psychosis and withdrawal discontinuation syndromes. Psychother Psychosom 2008; 77:69–77.
- Howes OD, et al. The nature of dopamine dysfunction in schizophrenia and what this means for treatment. Arch Gen Psychiatry 2012; 69:776–786.
- Joyce JN. D2 but not D3 receptors are elevated after 9 or 11 months chronic haloperidol treatment: influence of withdrawal period. Synapse 2001; 40:137–144.
- Quinn R. Comparing rat’s to human’s age: how old is my rat in people years? Nutrition 2005; 21:775–777.
- Marsden CD. Is tardive dyskinesia a unique disorder? Psychopharmacology Suppl 1985; 2:64–71.
- Lako IM, et al. Estimating dopamine D2receptor occupancy for doses of 8 antipsychotics: a meta-analysis. J Clin Psychopharmacol 2013; 33:675–681.
- Holford N. Pharmacodynamic principles and the time course of delayed and cumulative drug effects. Translational and Clinical Pharmacology 2018; 26:56–59.
- Leucht S, et al. Dose-response meta-analysis of antipsychotic drugs for acute schizophrenia. Am J Psychiatry 2020; 177:342–353.
- Horowitz MA, et al. Tapering antipsychotic treatment. JAMA Psychiatry 2021; 78:125–126.
- Huhn M, et al. Reducing antipsychotic drugs in stable patients with chronic schizophrenia or schizoaffective disorder: a randomized controlled pilot trial. Eur Arch Psychiatry Clin Neurosci 2021; 271:293–302.
- Liu CC, et al. Achieving the lowest effective antipsychotic dose for patients with remitted psychosis: a proposed guided dose-reduction algorithm. CNS Drugs 2020; 34:117–126.
- Ozawa C, et al. Model-guided antipsychotic dose reduction in schizophrenia: a pilot, single-blind randomized controlled trial. J Clin Psychopharmacol 2019; 39:329–335.
- Prien RF, et al. Relapse in chronic schizophrenics following abrupt withdrawal of tranquillizing medication. Br J Psychiatry 1969; 115:679–686.

