チックとトゥレット症
一過性のチックは小児の5-20%に生じる。トゥレット症(TS)は小児の約1%に生じ,持続的な運動性チックと音声チックが特徴的である。TS患者の65%では,成人期においてチックは消失するか,非常に軽度になる。チックは経時的に症状が重くなったり軽くなったりし,また個人差があるがストレス,非活動性,倦怠感等の外部要因によっても悪化する。チックは男児の方が女児よりも約2-3倍多い1。
併存疾患の発見と治療
チックにおいてOCD,注意欠陥・多動性障害,うつ病,不安,行動の問題等が併存する頻度は偶発的頻度を上回り,このような併存症はTS患者にしばしば重大な障害をもたらす2。通常は,チックによる障害を評価する前にこれらの併存症の治療を行う3。
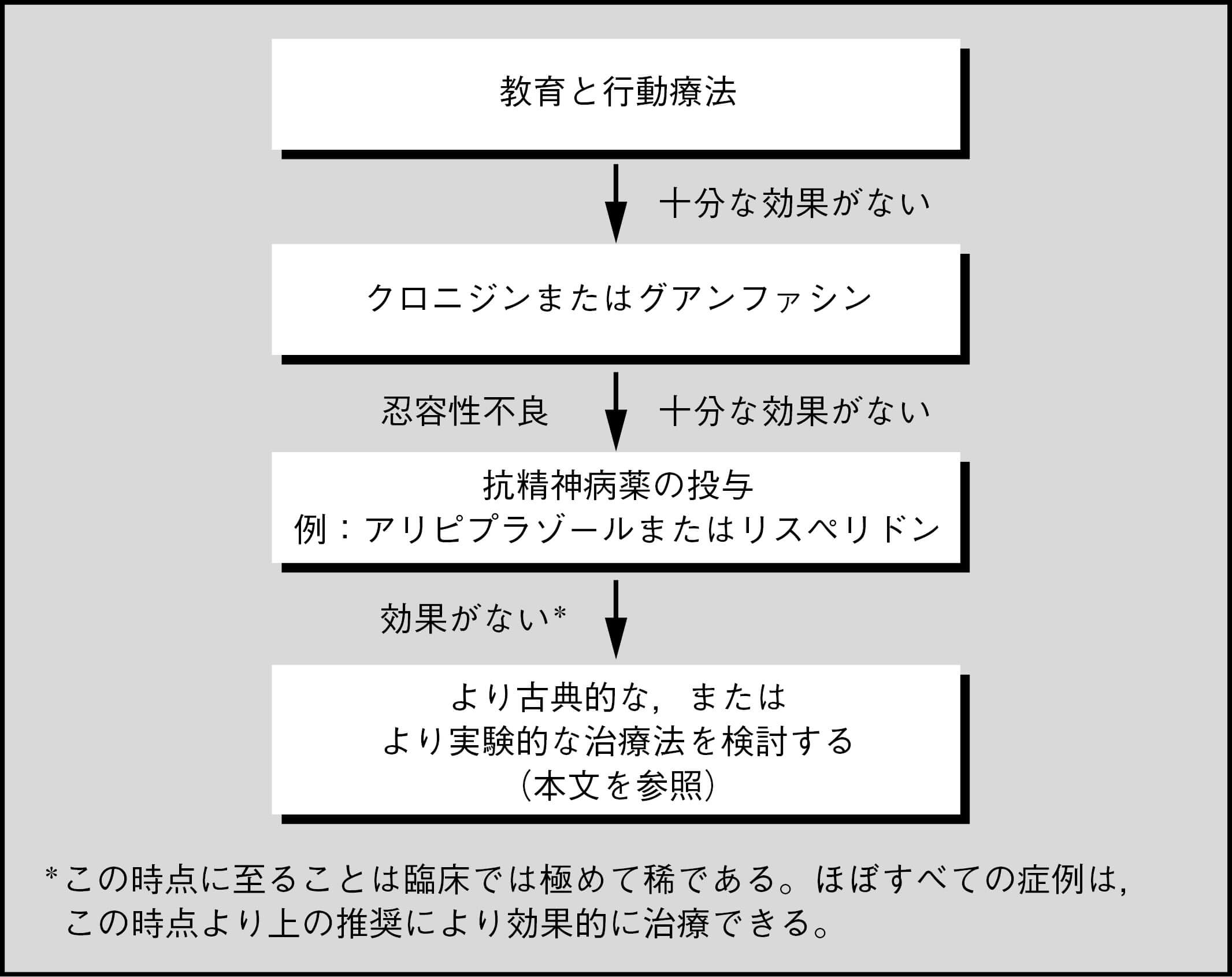
教育と行動療法
チックを有する人々の多くは薬物療法を必要とせず,本人および家族,関係者,特に学校関係者に対する教育が極めて重要である。チックが患者に苦痛や機能障害をもたらしている場合には,チックの緩和を目的とした治療が必要である。行動療法は,薬物療法と同程度の効果量で有効であることが明らかになった4, 5。行動療法では,習慣逆転法,包括的行動的介入,および曝露反応妨害法が選択肢である6。
薬物療法
TSに対する薬理学的介入に関する研究の解釈は,以下に示す理由により難しい。
- チックの頻度と重症度は個人差が大きい。小規模な無作為化試験では,ベースライン時に頻度や重症度が多様な被験者を組み入れている可能性がある。
- 患者個々のチックの重症度は経時的に著しく変化し,自然経過と薬物療法による効果を区別することは難しい。
- 文献の大半が症例報告,症例集積研究,非盲検研究,および検出力の低い無作為化比較試験である。出版バイアスも問題となるかもしれない。
- 患者の多くは精神疾患を併存しているため,チックに対する直接の効果と併存疾患に対する効果とを区別することが難しい。このため,研究がチックに対する特異的な効果よりも全体的な機能の改善を報告していると,解釈が困難になる。
- TSによる受診患者の多くは補完療法や代替療法を使用していると思われ,その大半が有効であると報告されており,半数近くが薬物療法に比べても有益であるとされている7。しかし,補完療法や代替療法の使用,有効性,潜在的な副作用に関する強固な研究は不足している8。
チック障害の臨床試験におけるプラセボ効果は,以前に考えられていたほど大きくはない9。
アドレナリンα2作動薬
クロニジンは非盲検研究でチックの重症度と頻度を減らすことが示されているが,1件の研究ではプラセボより効果が十分に上回るとはいえなかった10。他の研究では,チックをかなり改善させることが示されている11-14。クロニジンの治療有効用量は3-5μg/kgで,用量は漸増していくべきである。経皮パッチも効果を示している15。主な副作用は,鎮静,起立性低血圧,抑うつである。クロニジンには反跳性高血圧のリスクがあるので,患者と家族には突然中止しないように情報提供をすべきである。グアンファシンもチックの治療に有効性が示されており16, 17,特定の患者群(例:ADHD併存例)には治療を試す価値があると考えられる。
抗精神病薬
抗精神病薬の副作用はチック治療の有益性を上回るおそれがあるため,最初にクロニジンまたはグアンファシンを試みることを推奨する。しかし,一部の患者ではアドレナリンα2作動薬よりも抗精神病薬の方がチックの軽減に有効な可能性がある。
TSには多数の第一世代抗精神病薬が使用されている18。最近のコクラン・レビューによれば,ピモジドは6件の試験のメタ解析で確実な有効性が示された19。これらの試験ではピモジドが,ハロペリドール(1件の試験),プラセボ(1件の試験),ハロペリドールおよびプラセボ(2件の試験),リスペリドン(2件の試験)と比較され,チックの軽減においてはプラセボより効果があり,リスペリドンとは同等の効果で,ハロペリドールよりは効果がやや劣ることが明らかになった。ピモジドの副作用はハロペリドールと比較すると少ないが,リスペリドンとは同等であった。ピモジドやハロペリドールを使用する際には,ECGのモニタリングが必須である。ハロペリドールはしばしば忍容性が不良である。副作用プロファイルを考慮すると,TSの治療としては第一世代抗精神病薬より第二世代抗精神病薬の使用が推奨されることが大半である18。
最近の研究では,アリピプラゾールは小児のTS(およびチック20)に対して有効で,忍容性も高いと示唆されている。10週間の多施設共同二重盲検無作為化プラセボ対照試験(N=61)では,アリピプラゾールによる治療はTS患者のチックを軽減することが示された。またアリピプラゾールは,血中プロラクチン濃度の減少,平均体重の増加(1.6kg),BMI増加,胴囲の増加と有意に相関した21。低用量アリピプラゾール(50kg未満の場合5mg/日,50kg以上の場合10mg/日),高用量アリピプラゾール(50kg未満の場合10mg/日,50kg以上の場合20mg/日),およびプラセボを8週間比較した別の無作為化二重盲検プラセボ対照試験(N=133)でも,アリピプラゾールの有効性が示された22。8週時点で,Yale Global Tic Severity Scale Total Tic Scoreを用いて測定したチックは,高用量群(−9.9,95%CI=−13.8 - −5.9)と低用量群(-6.3,95%CI=−10.2 - −2.3)のいずれも減少し,また,チックがとても改善した者,および改善した者の割合は,低用量群の69%(29/42),高用量群の74%(26/35)であり,プラセボ群(38%,16/42)と比較して多かった。驚くべきことに,低用量群(18.2%)は,高用量群(9.3%)およびプラセボ群(9.1%)と比べて臨床的に重要な体重増加(≧7%)を経験した割合が高かった。これは,この群の投与前体重の平均が他の2群に比べて3kg強低かったことと関連しているのかもしれない。いくつかの症例集積研究でもチックならびにTSに対するアリピプラゾールの使用を支持している23-26。アリピプラゾール(N=25)とピモジド(N=25)をTS患者に24ヵ月間投与して代謝関連の副作用を評価した研究では,治療薬の投与はBMIの増加とは有意な相関を認めなかった。しかし,ピモジドは12-24ヵ月後のプラトーに達しない血糖値上昇と相関し,アリピプラゾールではコレステロール増加がみられ,どちらの薬剤でもトリグリセリド値が増加した27。2件のメタ解析でもアリピプラゾールのチックおよびTSに対する有効性が支持されている28, 29。1件の研究では30,週2回投与の方が連日投与よりも忍容性が優れている可能性が示唆されている。小規模無作為化比較試験(N=24)では,TS児を対象にアリピプラゾールをバルプロ酸ナトリウムと比較した結果,アリピプラゾールはバルプロ酸ナトリウムよりも,統計学的に有意なチックの減少を示した31。
リスペリドンについては,上記の研究の他に小規模無作為化試験(N=34)でプラセボより有効であることが示されている32。リスペリドン群では倦怠感と食欲増進が問題となり,8週間で平均2.8kgの体重増加が報告されている。1件の小規模無作為化比較試験では,リスペリドンとクロニジンの効果は同等であることが示された33。小規模な二重盲検クロスオーバー試験では,オランザピン34はピモジドよりも有効である可能性が示唆された。スルピリドは有効で忍容性が比較的良好であり35,ziprasidone36も同様であることが示唆されている。いくつかの非盲検試験では,クエチアピン37とオランザピン38, 39の効果が支持されている。1件の非常に小規模なクロスオーバー試験(N=7)では,クロザピンの効果は認められなかった40。
全般的に,第二世代抗精神病薬ではアリピプラゾールでさえ,代謝関連の副作用と体重増加が多いため,リスク・ベネフィット比については慎重に議論する必要がある18。
他の薬剤
バクロフェンの小規模二重盲検プラセボ対照クロスオーバー試験では,チックへの特異的な効果よりも全般的な機能障害に対する有効性が示唆された41。この研究で示されたバクロフェンの有益性は,数字的には統計学的有意差に達しなかった。同様に,ニコチンについてはハロペリドールの増強療法として二重盲検プラセボ対照試験が行われ,チックへの特異的な効果よりも全般的な機能障害に対する有益な効果が示された42。この有益性は,ニコチン(パッチ剤)を中止した後も数週間持続した。ニコチンパッチによる悪心および嘔吐の発現率は高かった(それぞれ71%および40%)。著者らは,頓用としての使用が適切かもしれないと述べている。ペルゴリド(D1-D2-D3作動薬)については,小児・青年期の患者を対象とした二重盲検プラセボ対照クロスオーバー試験において,低用量投与でチックの発生を有意に減少させた43。副作用として,鎮静,めまい,悪心,易刺激性を認めた。ペルゴリドは小児・青年期の慢性のチックおよびTSに対しても無作為化試験で評価され,プラセボに比較してチックを有意に減少させることが示された44。抗アンドロゲン薬のフルタミドについては,成人のTS患者を対象とした小規模RCTで検討されている。運動性チックに対しては短期間のわずかな効果がみられたが,音声チックに対しては効果がなかった45。小規模無作為化比較試験では,メトクロプラミド46とトピラマート47がプラセボより有意な効果があると示唆されている。1件のメタ解析では,トピラマートとハロペリドールまたはチアプリドを比較した14件の無作為化比較試験(すべて中国からの報告)を特定した。このメタ解析では,これらの試験は全体的に研究デザインの質が低く,トピラマートを臨床でルーチンに使うことを支持するエビデンスは不十分であると結論付けている48。最近では,モノアミンを枯渇させる作用を有する薬剤であるdeutetrabenazineの使用が有効であることが示された49。テトラベナジンも追加療法として有用である可能性がある50。D1受容体拮抗薬ecopipamも,TSの小児・青年期の患者を含めた最近の無作為化プラセボ対照クロスオーバー試験において,チックの治療に有効であることが明らかになった51。
オンダンセトロン52,クロミフェン53,トラマドール54,ketanserin55,cyproterone56,レベチラセタム57,プレガバリン58,大麻59の有効性を示唆する症例報告や症例集積研究が報告されている。カンナビノイドに関する最近のコクラン・レビューでは,現時点では有効性を示すエビデンスはほとんど得られていないと結論付けており60,使用のための強い生物学的な論拠があるにもかかわらず,全体的な有効性および安全性はほとんど明らかになっていない61。その他の多くの薬剤については,複数の一例報告において有効性が報告されている。これらの報告の患者はすべて精神疾患を併発しており,これらの薬剤がTSのみに奏効したか否かを判断するのは困難である。
ボツリヌス毒素は,厄介で苦痛を伴う顔面運動チック,特に頸部の筋肉に現れるチックの治療に使用されている18。しかし最近のコクラン・レビューでは,エビデンスの質が低いことから,チックの治療法として明確に位置付けていない62。
溶連菌感染またはその他の感染症/誘因と関連するチックや,強迫性障害を発症する小児のサブグループもあるようである。この患者群は,(溶連菌の場合)小児自己免疫性溶連菌感染関連性精神神経障害(PANDAS)63,またはより広く小児急性発症精神神経症候群(PANS)と呼ばれる64。PANDASは自己免疫が介在した反応と考えられるため,これらの小児患者には免疫調節療法が試され,活動性感染症の抗生物質による治療および予防が行われている。この分野ではさらなる研究が必要である(図5.2)。
図5.2 チック/トゥレット症の治療における推奨事項の要約
<編集協力者コメント>
本邦でのクロニジンの保険適用は「各種高血圧症」,グアンファシンは「注意欠陥/多動性障害」である。
(多田 光宏)
参照文献
- Murphy TK, et al. Practice parameter for the assessment and treatment of children and adolescents with tic disorders. J Am Acad Child Adolesc Psychiatry 2013; 52:1341–1359.
- Cath DC, et al. European clinical guidelines for Tourette syndrome and other tic disorders. Part I: Assessment. Eur Child Adolesc Psychiatry 2011; 20:155–171.
- Singer HS Treatment of tics and Tourette syndrome. Curr Treat Options Neurol 2010; 12:539–561.
- McGuire JF, et al. A meta-analysis of behavior therapy for Tourette syndrome. J Psychiatr Res 2014; 50:106–112.
- Rizzo R, et al. A randomized controlled trial comparing behavioral, educational, and pharmacological treatments in youths with chronic tic disorder or Tourette syndrome. Frontiers Psychiatry 2018; 9:100.
- Fründt O, et al. Behavioral therapy for Tourette syndrome and chronic tic disorders. Neurol Clin Practice 2017; 7:148–156.
- Patel H, et al. Use of complementary and alternative medicine in children with Tourette syndrome. J Child Neurol 2020; 35:512–516.
- Kumar A, et al. A comprehensive review of Tourette syndrome and complementary alternative medicine. Current Dev Disorders Rep 2018; 5:95–100.
- Cubo E, et al. Impact of placebo assignment in clinical trials of tic disorders. Mov Disord 2013; 28:1288–1292.
- Goetz CG, et al. Clonidine and Gilles de la Tourette’s syndrome: double-blind study using objective rating methods. Ann Neurol 1987; 21:307–310.
- Leckman JF, et al. Clonidine treatment of Gilles de la Tourette’s syndrome. Arch Gen Psychiatry 1991; 48:324–328.
- Group TsSS. Treatment of ADHD in children with tics: a randomized controlled trial. Neurology 2002; 58:527–536.
- Du YS, et al. Randomized double-blind multicentre placebo-controlled clinical trial of the clonidine adhesive patch for the treatment of tic disorders. Aust N Z J Psychiatry 2008; 42:807–813.
- Hedderick EF, et al. Double-blind, crossover study of clonidine and levetiracetam in Tourette syndrome. Pediatr Neurol 2009; 40:420–425.
- Song PP, et al. The efficacy and tolerability of the clonidine transdermal patch in the treatment for children with tic disorders: a prospective, open, single-group, self-controlled study. Front Neurol 2017; 8:32.
- Scahill L, et al. A placebo-controlled study of guanfacine in the treatment of children with tic disorders and attention deficit hyperactivity disorder. Am J Psychiatry 2001; 158:1067–1074.
- Cummings DD, et al. Neuropsychiatric effects of guanfacine in children with mild Tourette syndrome: a pilot study. Clin Neuropharmacol 2002; 25:325–332.
- Roessner V, et al. Pharmacological treatment of tic disorders and Tourette syndrome. Neuropharmacology 2013; 68:143–149.
- Pringsheim T, et al. Pimozide for tics in Tourette’s syndrome. Cochrane Database Syst Rev 2009:CD006996.
- Yoo HK, et al. An open-label study of the efficacy and tolerability of aripiprazole for children and adolescents with tic disorders. J Clin Psychiatry 2007; 68:1088–1093.
- Yoo HK, et al. A multicenter, randomized, double-blind, placebo-controlled study of aripiprazole in children and adolescents with Tourette’s disorder. J Clin Psychiatry 2013; 74:e772–e780.
- Sallee F, et al. Randomized, double-blind, placebo-controlled trial demonstrates the efficacy and safety of oral aripiprazole for the treatment of Tourette’s disorder in children and adolescents. J Child Adolesc Psychopharmacol 2017; 27:771–781.
- Davies L, et al. A case series of patients with Tourette’s syndrome in the United Kingdom treated with aripiprazole. Human Psychopharmacol 2006; 21:447–453.
- Seo WS, et al. Aripiprazole treatment of children and adolescents with Tourette disorder or chronic tic disorder. J Child Adolesc Psychopharmacol 2008; 18:197–205.
- Murphy TK, et al. Open label aripiprazole in the treatment of youth with tic disorders. J Child Adolesc Psychopharmacol 2009; 19:441–447.
- Wenzel C, et al. Aripiprazole for the treatment of Tourette syndrome: a case series of 100 patients. J Clin Psychopharmacol 2012; 32:548–550.
- Rizzo R, et al. Metabolic effects of aripiprazole and pimozide in children with Tourette syndrome. Pediatr Neurol 2012; 47:419–422.
- Liu Y, et al. Effectiveness and tolerability of aripiprazole in children and adolescents with Tourette’s disorder: a meta-Analysis. J Child Adolesc Psychopharmacol 2016; 26:436–441.
- Wang S, et al. The efficacy and safety of aripiprazole for tic disorders in children and adolescents: a systematic review and meta-analysis. Psychiatry Res 2017; 254:24–32.
- Ghanizadeh A Twice-weekly aripiprazole for treating children and adolescents with tic disorder, a randomized controlled clinical trial. Ann General Psychiatry 2016; 15:21.
- Tao D, et al. Randomized controlled clinical trial comparing the efficacy and tolerability of aripiprazole and sodium valproate in the treatment of Tourette syndrome. Ann General Psychiatry 2019; 18:24.
- Scahill L, et al. A placebo-controlled trial of risperidone in Tourette syndrome. Neurology 2003; 60:1130–1135.
- Gaffney GR, et al. Risperidone versus clonidine in the treatment of children and adolescents with Tourette’s syndrome. J Am Acad Child Adolesc Psychiatry 2002; 41:330–336.
- Onofrj M, et al. Olanzapine in severe Gilles de la Tourette syndrome: a 52-week double-blind cross-over study vs. low-dose pimozide. J Neurol 2000; 247:443–446.
- Robertson MM, et al. Management of Gilles de la Tourette syndrome using sulpiride. Clin Neuropharmacol 1990; 13:229–235.
- Sallee FR, et al. Ziprasidone treatment of children and adolescents with Tourette’s syndrome: a pilot study. J Am Acad Child Adolesc Psychiatry 2000; 39:292–299.
- Mukaddes NM, et al. Quetiapine treatment of children and adolescents with Tourette’s disorder. J Child Adolesc Psychopharmacol 2003; 13:295–299.
- Budman CL, et al. An open-label study of the treatment efficacy of olanzapine for Tourette’s disorder. J Clin Psychiatry 2001; 62:290–294.
- McCracken JT, et al. Effectiveness and tolerability of open label olanzapine in children and adolescents with Tourette syndrome. J Child Adolesc Psychopharmacol 2008; 18:501–508.
- Caine ED, et al. The trial use of clozapine for abnormal involuntary movement disorders. Am J Psychiatry 1979; 136:317–320.
- Singer HS, et al. Baclofen treatment in Tourette syndrome: a double-blind, placebo-controlled, crossover trial. Neurology 2001; 56:599–604.
- Silver AA, et al. Transdermal nicotine and haloperidol in Tourette’s disorder: a double-blind placebo-controlled study. J Clin Psychiatry 2001; 62:707–714.
- Gilbert DL, et al. Tourette’s syndrome improvement with pergolide in a randomized, double-blind, crossover trial. Neurology 2000; 54:1310–1315.
- Gilbert DL, et al. Tic reduction with pergolide in a randomized controlled trial in children. Neurology 2003; 60:606–611.
- Peterson BS, et al. A double-blind, placebo-controlled, crossover trial of an antiandrogen in the treatment of Tourette’s syndrome. J Clin Psychopharmacol 1998; 18:324–331.
- Nicolson R, et al. A randomized, double-blind, placebo-controlled trial of metoclopramide for the treatment of Tourette’s disorder. J Am Acad Child Adolesc Psychiatry 2005; 44:640–646.
- Jankovic J, et al. A randomised, double-blind, placebo-controlled study of topiramate in the treatment of Tourette syndrome. J Neurol Neurosurg Psychiatry 2010; 81:70–73.
- Yang CS, et al. Topiramate for Tourette’s syndrome in children: a meta-analysis. Pediatr Neurol 2013; 49:344–350.
- Jankovic J, et al. 152 development of deutetrabenazine as a potential new non-antipsychotic treatment for Tourette syndrome in children and adolescents. CNS Spectr 2020; 25:297.
- Porta M, et al. Tourette’s syndrome and role of tetrabenazine: review and personal experience. Clin Drug Invest 2008; 28:443–459.
- Gilbert DL, et al. Ecopipam, a D1 receptor antagonist, for treatment of Tourette syndrome in children: a randomized, placebo-controlled crossover study. Mov Disord 2018; 33:1272–1280.
- Toren P, et al. Ondansetron treatment in patients with Tourette’s syndrome. Int Clin Psychopharmacol 1999; 14:373–376.
- Sandyk R Clomiphene citrate in Tourette’s syndrome. Int J Neurosci 1988; 43:103–106.
- Shapira NA, et al. Novel use of tramadol hydrochloride in the treatment of Tourette’s syndrome. J Clin Psychiatry 1997; 58:174–175.
- Bonnier C, et al. Ketanserin treatment of Tourette’s syndrome in children. Am J Psychiatry 1999; 156:1122–1123.
- Izmir M, et al. Cyproterone acetate treatment of Tourette’s syndrome. Can J Psychiatry 1999; 44:710–711.
- Awaad Y, et al. Use of levetiracetam to treat tics in children and adolescents with Tourette syndrome. Mov Disord 2005; 20:714–718.
- Hienert M, et al. Pregabalin in Tourette’s syndrome: a case series. Am J Psychiatry 2016; 173:1242–1243.
- Sandyk R, et al. Marijuana and Tourette’s syndrome. J Clin Psychopharmacol 1988; 8:444–445.
- Curtis A, et al. Cannabinoids for Tourette’s syndrome. Cochrane Database Syst Rev 2009:CD006565.
- Artukoglu BB, et al. The potential of cannabinoid-based treatments in Tourette syndrome. CNS Drugs 2019; 33:417–430.
- Pandey S, et al. Botulinum toxin for motor and phonic tics in Tourette’s syndrome. Cochrane Database Syst Rev 2018; 1:Cd012285.
- Martino D, et al. The PANDAS subgroup of tic disorders and childhood-onset obsessive-compulsive disorder. J Psychosom Res 2009; 67:547–557.
- Chang K, et al. Clinical evaluation of youth with pediatric acute-onset neuropsychiatric syndrome (PANS): recommendations from the 2013 PANS Consensus Conference. J Child Adolesc Psychopharmacol 2015; 25:3–13.

